
����Ŀ����������������Ԫ�أ����ܻ�������Ϊ���ϣ������ƾõ���ʷ���ڻ�е���졢���Բ��ϵ�����Ҳ���й㷺��Ӧ�ã���ش���������:
��1��Co��̬ԭ�ӵĵ����Ų�ʽΪ_____��
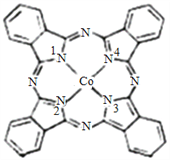
��2��̪ݼ�ܽ������ڹ����ϡ������Թ�ѧ���ϡ����ѧ�еĹ������������ȷ���õ��㷺��Ӧ�ã���ṹ��ͼ��ʾ����������Ϊ�����ӡ�
��̪ݼ�������ַǽ���ԭ�ӵĵ縺���д�С��˳��Ϊ_________ (����Ӧ��Ԫ�ط�������)��̼ԭ�ӵ��ӻ��������Ϊ__________��
����������ͨ����λ����ϵĵ�ԭ�ӵı����_____________��
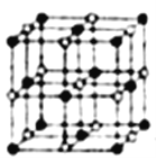
��3��Co��һ��������ľ�����ͼ��ʾ���ڸþ�������һ����ԭ�ӵȾ������������ԭ����______������֪�ڸ��ܵ������ᄃ������ԭ�ӵİ뾶Ϊapm����ԭ�ӵİ뾶Ϊbpm�������ھ������ǽ��ܽӴ��ģ����ڸ��ܵ������ᄃ����ԭ�ӵĿռ�������Ϊ____(�ú�a��b��ʽ�ӱ�ʾ)��
��4���������Ͽ�ѧ����ʵ����һ������С�鷢������5K�³��ֳ����Եľ��壬�þ������CoO2�IJ�״�ṹ(����ͼ��ʾ��С���ʾCoԭ�ӣ������ʾOԭ��)�������ô��������ظ��ṹ��Ԫʾ��ͼ�У���������CoO2�Ļ�ѧ��ɵ���_______��
 ��
��
���𰸡� 1s22s22p63s23p63d74s2 N>C>H sp2 2��4 6 ![]() D
D
��������������CoΪ27��Ԫ�أ�Ԫ�صķǽ�����Խǿ����縺��Խ����Nԭ�ӳɼ�����ж����Ƿ�����γ���λ�������ݾ����ṹȷ����λ�������ݾ�����ԭ�ӵ�������;����������ԭ�ӵĿռ������ʣ����ݾ�̯����ԭ�Ӹ����������뻯ѧʽ�Ƚϡ�
��⣺��1��Co��̬ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p63d74s2 ��
��2����̪ݼ�������ַǽ���ԭ�ӵĵ縺���д�С��˳��ΪN>C>H���ɷ��ӽṹʾ��ͼ��֪������������̼ԭ�ӵ��ӻ�������;�Ϊsp2��
����ͼ��֪�����Ϊ1��3��Nԭ��ǡ���γ�3���Ҽ��������Ϊ2��4��Nԭ�ӳ��γ�3���Ҽ��⣬���ֱ��γ���һ���м�������Nԭ�ӵļ۵�������5�������γ�3���Ҽ�����۲���Ӿʹﵽ����ȶ��Ľṹ������������ͨ����λ����ϵĵ�ԭ�ӵı����2��4 ��
��3���ɾ����ṹʾ��ͼ��֪���þ������Ȼ��ƾ���ľ������ƣ��ڸþ���������ԭ�ӵ���λ����Ϊ6������һ����ԭ�ӵȾ������������ԭ����6������������֪�ڸ��ܵ������ᄃ������ԭ�ӵİ뾶Ϊapm����ԭ�ӵİ뾶Ϊbpm�������ھ������ǽ��ܽӴ��ģ���þ����ı߳�Ϊ(2a+2b)pm�����������Ϊ(2a+2b)3pm3���þ�������4��Co��4��O��4��Co��4��O�������Ϊ![]() �����ԣ����ܵ������ᄃ����ԭ�ӵĿռ�������Ϊ
�����ԣ����ܵ������ᄃ����ԭ�ӵĿռ�������Ϊ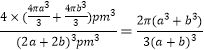 ��
��
��4����CoO2�IJ�״�ṹʾ��ͼ��֪��A����������Oԭ����Ϊ4![]() ��Coԭ����Ϊ1��B����������Oԭ����Ϊ4��Coԭ����Ϊ4
��Coԭ����Ϊ1��B����������Oԭ����Ϊ4��Coԭ����Ϊ4![]() ��C����������Oԭ����Ϊ4
��C����������Oԭ����Ϊ4![]() ��Coԭ����Ϊ2
��Coԭ����Ϊ2![]() ��D����������Oԭ����Ϊ4
��D����������Oԭ����Ϊ4![]() ��Coԭ����Ϊ1�������������ô��������ظ��ṹ��Ԫʾ��ͼ������������CoO2�Ļ�ѧ��ɵ���D��
��Coԭ����Ϊ1�������������ô��������ظ��ṹ��Ԫʾ��ͼ������������CoO2�Ļ�ѧ��ɵ���D��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ���ڵؿ��к��������������䵥�ʼ��仯�������������������ء������йع輰�仯����Ӧ�õ�˵���������
A.����������������άB.�轺������������������������
C.ˮ������������ľ�ķ����D.ʯӢɰ����������ȡ�赥��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����1mol���ʯ������Ϊa g���ܶ�Ϊ��g��cm��3��������ÿ��̼ԭ�ӵĹ��۰뾶________������ԭ�Ӻ�֮������һ�룩����̼ԭ��Ϊ���ܶѻ��ṹ����ͼ����(�ú�a���ѣ�NA��ʽ�ӱ�ʾ��NA��ʾ�����ӵ�������ֵ)

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������ȷ����
A.��������У�����������ȴˮ���������Ͻ��³�
B.����ʱ��Ҫ�����ò��������裬����Һ���ɺ�Ӧ����ֹͣ����
C.�������ھƾ������þƾ��ӱ��͵�ˮ����ȡ��
D.��Һʱ�²�Һ��ӷ�Һ©���¿ڷų����ϲ�Һ��ӷ�Һ©���Ͽڵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ǵӻƻ�������ȡ��һ����ɫ��״���壬˫���������������ص���Ҫ�������ű����Ч���������أ���ش��������⣺
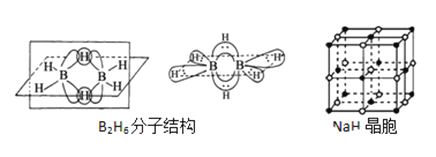
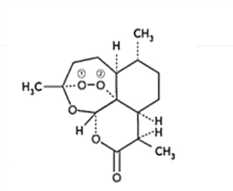
��1����������ص�����Ԫ�ص縺���ɴ�С������__________��������̬Oԭ�ӵļ۵����Ų�ͼ__________��
��2��һ�������ط����к���_______������̼ԭ�ӡ�
��3��˫�������صĺϳ�һ���������⻯��(NaBH4)��ԭ�����أ����⻯��ĺϳɷ����У� 2LiH+B2H6=2LiBH4�� 4NaH+BF3�TNaBH4+3NaF
��д��BH4���ĵȵ�����_________�����ӡ����Ӹ�дһ�֣���
��B2H6���ӽṹ��ͼ��2��Bԭ�Ӻ�һ��Hԭ�ӹ���2�������γ�3���Ķ����Ӽ����м��2����ԭ�ӱ���Ϊ������ԭ����������������2��Bԭ�ӣ���B2H6��������______�ֹ��ۼ���
��NaBH4����������һ��Bԭ�����γ�4�����ۼ���������ʯ(Na3AlF6)����������һ��Alԭ�ӿ����γ�6�����ۼ���ԭ����______________��
��NaH�ľ�����ͼ����NaH�����������ӵ���λ����_________���辧��������������Ϊ����������ǡ�����У������������ӵİ뾶��![]() =__________�ɴ˿�֪�������ӵİ뾶���Ǿ������Ӿ���ṹ����Ҫ���أ���Ƽ������أ�����֮��Ӱ�����Ӿ���ṹ�����ػ���_________��_________��
=__________�ɴ˿�֪�������ӵİ뾶���Ǿ������Ӿ���ṹ����Ҫ���أ���Ƽ������أ�����֮��Ӱ�����Ӿ���ṹ�����ػ���_________��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ��Ľṹ��ʽ��ͼ�������й���ԭ���˵��������ǣ�������
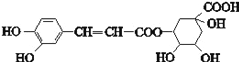
A. ����ʽΪC16H18O9 B. ����NaHCO3��Ӧ
C. �ܷ���ȡ����Ӧ��������Ӧ����ȥ��Ӧ D. 1 mol��ԭ�������6 mol Br2��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(һ)������ͭˮ��Һ�м��백ˮ��������������������Ӱ�ˮ���������ܽ⣬����������Һ����ɫ��ԭ�����Լ���õ���һ�ֺ�2+����Һ�������ӵ�����ṹ��ͼ��ʾ��4��NH3��Cu2+���棬��H2O��Cu2+��H2O���ߴ�ֱ������ش��������⣺
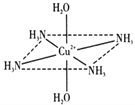
(1)����ͭˮ��Һ�Ӱ�ˮ�ı仯���̣������ӷ���ʽ��ʾΪ��������ɫ��Һ��__________��
(2)������ɫ��������Cu2+��H2O��NH3�γɵ���________��������ͼ�б�ʾ�˻�ѧ��________��������ɫ���ӵĿռ�ṹ��________�Σ�
���������������ᆳ�Ȼ����������Ȼ����ǹ�ҵ�����Ȼ���ij��÷�����Cl2��CCl4�dz��õ��Ȼ������磺Na2O��Cl2��2NaCl��O2��CaO��Cl2��CaCl2��O2��SiO2��2CCl4��SiCl4��2COCl2��Cr2O3��3CCl4��2CrCl3��3COCl2����ش��������⣺
�����ͬ���ڵ�����Ԫ�صĻ�̬ԭ�����������������ԭ����ͬ��Ԫ����______����Ԫ�ط��ţ�������һ�ֽ����ľ����ṹ��ͼ��ʾ���þ����к��н���ԭ�ӵ���ĿΪ_____��
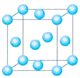
��2��COCl2�׳ƹ�����������Cԭ�Ӳ�ȡsp2�ӻ��ɼ�������̼��ԭ��֮�乲�ۼ���____������ţ�
a��2���Ҽ� b��2���м� c��1���Ҽ���1���м�
��3��CaO������ͼ��ʾ��CaO������Ca2������λ��Ϊ_________��CaO�����NaCl�������������з�ʽ��ͬ���侧���ֱܷ�Ϊ��CaO��3401kJmol��1��NaCl��786kJmol��1���������߾����ܲ������Ҫԭ����_____________________________________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��Ϊ����֤���ӡ������̼�������ǿ�����������ͼ��ʾʵ��װ�á�
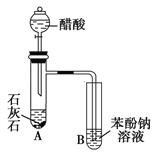
��ش��������⣺
��1������B�е�ʵ������____________________________________________��
��2������B�з�����Ӧ�Ļ�ѧ����ʽ��___________________________��
��3����ʵ����Ʋ����ܣ��������____________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�� �� 25��ʱ��NH4Cl��Һ�����ԣ�ԭ����______ˮ������ģ�����NH4+������Cl-������
�� �����£�0.0100mol/L NaOH��Һ��pH=___________��
�� ��0.0100mol/L ����ζ�δ֪Ũ�ȵ�NaOH��Һ����̪��ָʾ�����ζ��յ�ʱ����Һ����ɫ��dz��ɫ��Ϊ_______��������ɫ��������ɫ�������Ұ��������ɫ���ֲ��䡣
�� ��֪��25�棺AgCl(s) ![]() Ag��(aq)��Cl��(aq) Ksp=1.8��10��10
Ag��(aq)��Cl��(aq) Ksp=1.8��10��10
Ag2S(s) ![]() 2Ag��(aq)��S2��(aq) Ksp=6.3��10��50
2Ag��(aq)��S2��(aq) Ksp=6.3��10��50
��Ũ�Ⱦ�Ϊ0.001 mol/L��NaCl��Na2S�Ļ����Һ�У���μ���AgNO3��Һ�����Ȳ����ij�����_________������AgCl������Ag2S������
��2����֪25��ϳɰ���Ӧ�У�1mol N2��ȫת��ΪNH3ʱ�ͷŵ�����Ϊ92.4 kJ���ֽ�1mol N2��3mol H2�������2L�ܱ������У���Ӧ���е�2sĩ���NH3Ϊ0.4mol��
�ش����У�
�� �÷�Ӧ���Ȼ�ѧ����ʽ��______________ ��
�� �÷�Ӧ�ﵽƽ��������¶�ƽ����_______ ����������������������Ӧ�����ƶ����������ƽ��________�������������������� ���������ƶ���
�� ǰ2s��v��H2����___________��
��3��ȼ�ϵ������ת���ʸߣ����й����ķ�չǰ������Ȼ��ȼ�ϵ���У��ڸ���������Ӧ�������� ________���ѧʽ��������õ���еĵ������Һ��KOH��Һ���缫B�缫�Ϸ����ĵ缫��Ӧʽ�ǣ�______________��
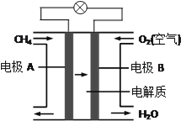 ��
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com