
分析 (1)依据蔗糖、淀粉在稀的酸溶液做催化剂条件下发生水解解答;
(2)蔗糖水解产物为葡萄糖、果糖,淀粉水解产物为葡萄糖,葡萄糖含有醛基,依据醛基检验方法即可检验.
解答 解:(1)蔗糖、淀粉在稀的酸溶液做催化剂条件下发生水解,所以)“一定条件”指的是稀酸催化作用下;
故答案为:稀酸催化作用下;
(2)蔗糖水解产物为葡萄糖、果糖,淀粉水解产物为葡萄糖,葡萄糖含有醛基,能够发生与新制的氢氧化铜反应生成砖红色沉淀,所以正确的方法为:先向水解后的溶液中加入足量氢氧化钠溶液中和过量的酸使溶液呈碱性,再加入新制的氢氧化铜并加热,若产生砖红色沉淀,说明存在醛基,说明淀粉和蔗糖已经水解;
故答案为:先向水解后的溶液中加入足量氢氧化钠溶液中和过量的酸使溶液呈碱性,再加入新制的氢氧化铜并加热,若产生砖红色沉淀,说明存在醛基,说明淀粉和蔗糖已经水解.
点评 本题考查了糖类的水解及产物判断,明确蔗糖、淀粉在酸性环境下水解及水解产物是解题关键,注意检验醛基,应在碱性环境下进行,可以依据银镜反应或者与新制氢氧化铜的反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.1a mol | B. | (0.1+a)mol | C. | (0.05+a)mol | D. | 2a mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量相同时,反应(Ⅰ)的反应物总能量比反应(Ⅱ)的反应物总能量高 | |
| B. | 反应(Ⅰ)和反应(Ⅱ)均为放热反应 | |
| C. | 反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定 | |
| D. | 1mol H2(g)通入1mol I2中在该条件下反应的反应放热为9.48 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应在水溶液中进行时,若A为金属,则B一定是金属 | |
| B. | 反应在水溶液中进行时,若A为非金属,则B一定是非金属 | |
| C. | 反应在加热或高温下进行时,若A为金属,则B一定是非金属 | |
| D. | 反应在加热或高温下进行时,若A为非金属,则B一定是金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
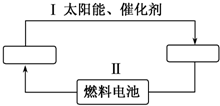 能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.
能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
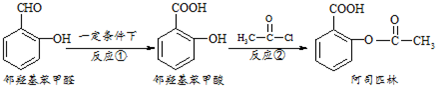
| A. | 与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化合物共有3 种 | |
| B. | 用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应① | |
| C. | 邻羟基苯甲醛不能和溴水发生取代反应 | |
| D. | 1mol阿司匹林最多可以和2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
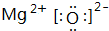 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com