
| A. | ①②③ | B. | ①②④ | C. | ①②⑤ | D. | 全部 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
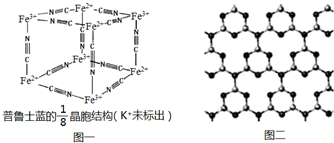
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数 |
| CH3COOH | Ka=1.76×10-5 |
| H2SO3 | ${K_{a_1}}$=1.54×10-2 |
| ${K_{a_2}}$=1.02×10-7 | |
| HF | Ka=6.03×10-4 |
| A. | 1mol•L-1NaHA溶液中一定存在:c(Na+)=c(H2A)+c(HA-)+c(A2-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | pH均等于3的醋酸与盐酸溶液等体积混合后,溶液的pH变大 | |
| D. | 已知某温度下常见弱酸的电离平衡常数如表:相同物质的量浓度的CH3COONa、NaF、Na2SO3、NaHSO3水溶液,溶液中离子总数由小到大排列的顺序是Na2SO3<CH3COONa<NaF<NaHSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
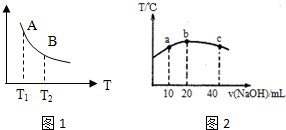
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
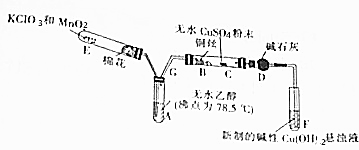
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入的物质 | 结论 | |
| A | 少量Ba(OH)2 | 反应结束后,c(CO32-)减小 |
| B | 再加入等量Na2CO3 | 溶液中c(CO32-)<c(HCO3-) |
| C | 100mLH2O | 由水电离出的c(H+)•c(OH-)不变 |
| D | 冰醋酸 | $\frac{c(C{O}_{3}^{2-})}{c(HC{{O}_{3}}^{-})}$增大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 自来水的体积 | KI溶液的体积 | 消耗的Na2S2O3溶液的体积 |
| 1 | 10.00mL | 10.00mL | 19.96mL |
| 2 | 10.00mL | 10.00mL | 20.04mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
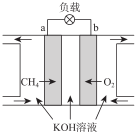
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com