
| 试剂 | 离子方程式 | |
| ①KCl (K2SO4) | ||
| ②Na2SO4 (MgSO4) | ||
| ③NaCl (Na2CO3) |
分析 ①硫酸钾与氯化钡反应生成硫酸钡沉淀和KCl;
②硫酸镁与NaOH反应生成氢氧化镁沉淀和硫酸钠;
③碳酸钠与盐酸反应生成氯化钠、水、二氧化碳,以此来解答.
解答 解:①硫酸钾与氯化钡反应生成硫酸钡沉淀和KCl,除杂试剂为BaCl2溶液,离子反应为Ba2++SO42-=BaSO4↓;
②硫酸镁与NaOH反应生成氢氧化镁沉淀和硫酸钠,除杂试剂为NaOH溶液,离子反应为Mg2++2OH-=Mg(OH)2↓;
③碳酸钠与盐酸反应生成氯化钠、水、二氧化碳,除杂试剂为CaCl2溶液或盐酸,离子反应为Ca2++CO32-=CaCO3↓( 2H++CO32-=CO2↑+H2O),
故答案为:
| 试剂 | 离子方程式 | |
| ①KCl (K2SO4) | BaCl2溶液 | Ba2++SO42-=BaSO4↓ |
| ②Na2SO4 (MgSO4) | NaOH溶液 | Mg2++2OH-=Mg(OH)2↓ |
| ③NaCl (Na2CO3) | CaCl2溶液或盐酸 | Ca2++CO32-=CaCO3↓( 2H++CO32-=CO2↑+H2O) |
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应、混合物分离提纯为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用及除杂的原则,题目难度不大.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
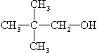 ;
;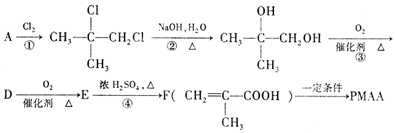

 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 +2H2O
+2H2O $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$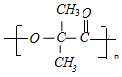 +nH2O.
+nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
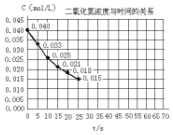 二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25秒内的反应进程.
二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25秒内的反应进程.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
| B | 17.9 | 290 | 1.26 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com