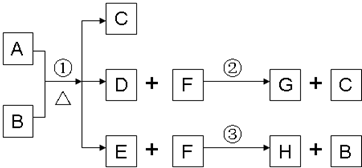
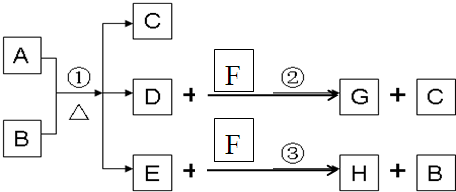
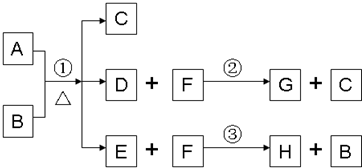
解:(1)G为淡黄色固体,应为S,说明除A、C外其余各物质均含同一种元素S,则F为H
2S,D应为SO
2,与H
2S反应生成S和
H
2O,所以C为H
2O,H为黑色沉淀,应为CuS,则A为Cu,B为H
2SO
4,浓硫酸与铜反应生成CuSO
4、SO
2和H
2O,则E为CuSO
4,反应的化学方程式为Cu+2H
2SO
4(浓)

CuSO
4+SO
2+2H
2O,
故答案为:Cu;SO
2;H
2S;S;CuS;Cu+2H
2SO
4(浓)

CuSO
4+SO
2+2H
2O;
(2)S和过量NaOH溶液在加热时反应,氧化产物与还原产物的物质的量之比为1:2,
反应的离子方程式为3S+6OH
-=2S
2-+SO
32-+3H
2O,故答案为:3S+6OH
-=2S
2-+SO
32-+3H
2O;
(3)实验室检验SO
42-的方法为取少量E溶液,先加入稀盐酸,再加入BaCl
2溶液,若产生白色沉淀,则证明有SO
42-存在,
故答案为:取少量E溶液,先加入稀盐酸,再加入BaCl
2溶液,若产生白色沉淀,则证明有SO
42-存在.
分析:(1)G为淡黄色固体,应为S,说明除A、C外其余各物质均含同一种元素S,则F为H
2S,D应为SO
2,与H
2S反应生成S和H
2O,所以C为H
2O,H为黑色沉淀,应为CuS,则A为Cu,B为H
2SO
4,浓硫酸与铜反应生成CuSO
4、SO
2和H
2O,则E为CuSO
4;
(2)根据反应物的物质的量关系结合物质的性质书写离子方程式;
(3)从SO
42-离子的检验方法解答.
点评:本题考查无机物的推断,题目难度中等,本题注意推断的几个关键点①G为淡黄色固体②H为黑色沉淀③除A、C外其余各物质均含同一种元素X.

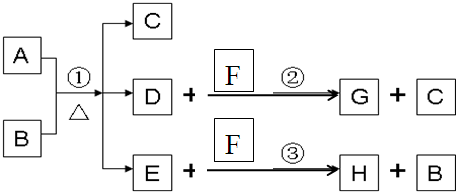
 CuSO4+SO2+2H2O,
CuSO4+SO2+2H2O, CuSO4+SO2+2H2O;
CuSO4+SO2+2H2O;

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案