
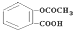
 ,试推断它不应具有的性质( )
,试推断它不应具有的性质( )| A. | 与NaOH溶液反应 | B. | 与金属钠反应 | ||
| C. | 与乙酸发生酯化反应 | D. | 一定条件下发生水解反应 |
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2与足量水反应转移的电子数为0.2NA | |
| B. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA | |
| C. | 常温常压下,1 mol CH4中含有的氢原子数为4NA | |
| D. | 12.0 g熔融的NaHSO4中含有0.1NA个Na+、0.1NA个H+和0.1NA个SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验:液体分层,上层呈紫红色 | |
| B. |  实验:烧杯中先出现白色沉淀,后溶解 | |
| C. |  实验:试管中溶液颜色变为血红色 | |
| D. |  实验:放置一段时间后,饱和CuSO4溶液中出现白色晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某工厂废水中含游离态氯,通过下列实验测定其浓度.
某工厂废水中含游离态氯,通过下列实验测定其浓度.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,则
,则 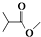 分子式:C5H8O2.
分子式:C5H8O2. .
. .
. 有多种同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是:
有多种同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是: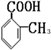 、
、 ;
; ,
,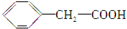 (任意两种)(任写其中二种).
(任意两种)(任写其中二种).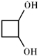 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
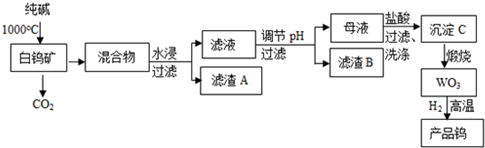
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com