
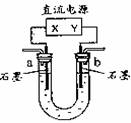
用右图装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中所列各项对应关系均正确的一组是 ( )
| 选项 | 电源X极 | 实验前U形管中液体 | 通电后现象及结论 |
| A | 正极 | Na2SO4溶液 | U形管两端滴入酚酞后, a管中呈红色 |
| B | 正极 | AgNO3溶液 | b管中电极反应式是4OH—4e-=2H2O+O2↑ |
| C | 负极 | KCl和CuCl2混合溶液 | 相同条件下,a、b两管中产生的气体总体积可能相等 |
| D | 负极 | AlCl3溶液 | a管中先产生白色沉淀后沉淀溶解 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知水和苯互不相溶,苯不与钠反应,在烧杯中加水和苯(密度:0.88g/cm3)各50mL.将一小粒金属钠(密度:0.97g/cm3)投入烧杯中,观察到的现象可能是()
| A. | 钠在水层中反应并四处游动 | |
| B. | 钠停留在苯层中不发生反应 | |
| C. | 钠在苯的液面上反应并四处游动 | |
| D. | 钠在苯与水的界面处反应并可能做上、下跳动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E均为有机物,它们具有下图的转化关系:
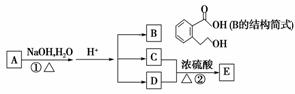
已知:C能与NaHCO3发生反应,C、D相对分子质量相等,E能发生银镜反应,相对分子质量为74。
请回答下列问题:
(1)写出C的名称:________,E中含有的官能团(写结构简式)________、________;写出有机物B可能发生的两种反应类型:_______________________;
(2)写出反应②的化学方程式:_____________________________________;
该反应需加热的目的是___________________________________________;
(3)A的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
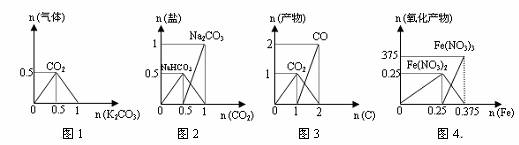
下列图象能正确表示相关反应中产物物质的量的变化的是(横、纵坐标单位:mol)( )
A.图1:n(HCl)=1mol,K2CO3逐步加入到HCl溶液中,在敞口容器中生成的气体
B.图2:n(NaOH)=1mol,CO2逐步通入到NaOH溶液中反应生成的盐
C.图3:n(O2)=1mol,高温下C和O2在密闭容器中的反应产物
D.图4:n(HNO3)=1mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。工艺流程如下图所示。
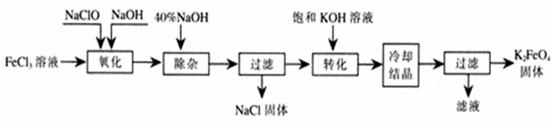
⑴ 写出“氧化”过程中反应的化学方程式: 。
⑵写出“转化”过程中发生反应的化学方程式为 。
⑶上述工艺得到的高铁酸钾常含有杂质,可用重结晶发提纯,操作是:将粗产品用 溶解,然后 。
方法Ⅱ:电解法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH。
⑷电解时阳极发生反应生成FeO42-,该电极反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
为检验某卤代烃(R—X)中的X元素,有下列实验操作:①加热煮沸 ②加入AgNO3溶液 ③取少量的卤代烃 ④加入稀硝酸酸化 ⑤加入NaOH溶液 ⑥冷却。正确操作的先后顺序是( )
A.③①⑤⑥②④ B.③②①⑥④⑤ C.③⑤①⑥④② D.③⑤①⑥②④
查看答案和解析>>
科目:高中化学 来源: 题型:
有机化合物有不同的分类方法,下列说法正确的是( )
①从组成元素分:烃,烃的衍生物 ②从分子中碳骨架形状分:链状有机化合物,环状有机化合物 ③从官能团分:烯烃、炔烃、芳香烃、卤代烃、醇、酚、醛、酮、羧酸、酯等
A.①③ B.①②
C.①②③ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。
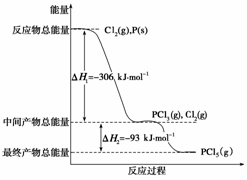
根据上图回答下列问题:
(1) P和Cl2反应生成PCl3的热化学方程式是
________________________________________________________________________
________________________________________________________________________。
(2) PCl5分解成PCl3和Cl2的热化学方程式是
________________________________________________________________________
________________________________________________________________________。
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80 mol PCl5,反应达到平衡时PCl5还剩0.60 mol,其α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2________α1(填“大于”、“小于”或“等于”)。
(3) 工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是__________________________________________
______________________。
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3=______,P和Cl2一步反应生成1 mol PCl5的ΔH4________ΔH3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com