
| A. | 体系的总压强不变 | |
| B. | 体系内各物质的质量分数不再发生变化 | |
| C. | 体系内气体密度不再发生变化 | |
| D. | 单位时间消耗0.1molCO(g)的同时生成0.1molH2O(g) |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、两边气体计量数相等,所以体系的总压强一直不变,故A错误;
B、体系内各物质的质量分数不再发生变化,说明各物质的量不变,说明反应达平衡状态,故B正确;
C、体系内气体密度一直不发生变化,故C错误;
D、单位时间消耗0.1molCO(g)等效于消耗0.1molH2O(g),同时生成0.1molH2O(g),正逆反应速率相等,反应达平衡状态,故D正确;
故选BD.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:选择题
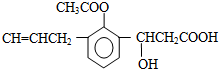
| A. | M中至少有8个碳原子共面 | |
| B. | M能发生还原、氧化、中和、缩聚、取代、加成、银镜等反应 | |
| C. | M中苯环上的一氯取代物有两种不同的结构 | |
| D. | 1molM消耗Na、NaOH、NaHCO3的物质的量的比是2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
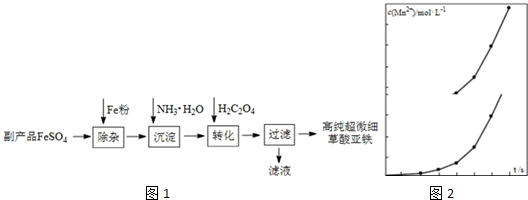
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
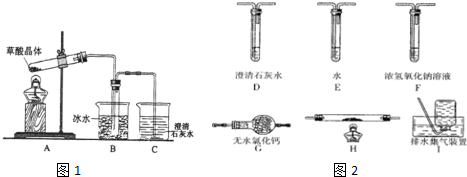
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L | B. | 2mol/L | C. | 4mol/L | D. | 8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加高工厂烟囱,使烟尘和废气远离地表 | |
| B. | 推广使用燃煤脱硫技术,防止SO2污染 | |
| C. | 研制新型高效可充电电池,发展电动汽车 | |
| D. | 开发利用绿色能源,替代化石燃料 |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用
B.向某溶液中滴加硝酸酸化的BaCl2溶液产生白色沉淀,则该溶液中含有SO2-4
C.在电解精炼铜过程中,阳极质量的减少多于阴极质量的增加
D.298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
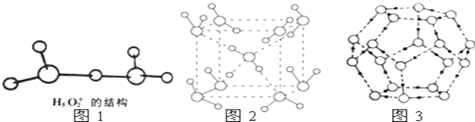
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com