
次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是
A.用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e- =O2↑+4H+
B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C.将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4
D.H3PO2溶于水的电离方程式为H3PO2 H++ H2PO2-
H++ H2PO2-
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源:2016-2017学年四川省高二12月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是 ( )
A、25℃时 Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
B、常温下,NaClO溶液显碱性的原因:ClO—+ H2O = HClO + OH—
C、2NO(g) + 2CO(g) = N2(g) + 2CO2(g),在常温下能自发进行,则该反应的△H >0
D、25℃时向水中加入少量NaOH后,由水电离出的c(H+)•c(OH—)不变
查看答案和解析>>
科目:高中化学 来源:2017届广西省钦州市高新区高三12月月考化学试卷(解析版) 题型:填空题
CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用。
I.(1)常温下中和100 mL pH=3的CH3COOH溶液和1 L pH=4的CH3COOH溶液,需要等物质的量浓度的NaOH溶液的体积分别为V1和V2,则V1_______V2(填“>”、“ =”或“<”)。
=”或“<”)。
(2)常温下,用0.1000 mol/L的NaOH溶液滴定20.00 mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。其中A点所示溶液中c(CH3COO-)=2c(CH3COOH),C点所示溶液中存在c(CH3COO-)+c(CH3COOH)=c(Na+)。则常温下CH3COOH的电离常数Ka=_________,CH3COOH溶液的实际浓度为____________。
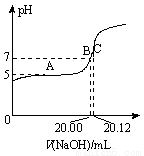
Ⅱ.1100℃时,体积为2 L的恒容容器中发生如下反应:
Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)下列能判断反应达到平衡状态的是________。
A.容器中压强不变
B.混合气体密度不变
C.1 mol H-H键断裂同时形成2 mol H-O
D.H2的体积分数不变
(2)若2 min时反应达平衡,此时气体质量增加8 g,则用H2表示该反应的反应速率为___________。
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,则该温度下的平衡常数K为_____________。
(4)若降低温度,K值减小,则反应的ΔH______0(填“>”或“<”)。
(5)若反应达平衡后,加入少量的H2,再次平衡后,H2O的体积分数___________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上学期期中化学试卷(解析版) 题型:选择题
甲、乙、丙、丁为四种主族元素,甲元素与乙、丙、丁三种元素直接相邻,甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20。下列判断正确的
A. 原子半径:丙>乙>甲>丁
B. 气态氢化物的稳定性:甲>丙
C. 最高价氧化物对应的水化物的酸性:丁>甲
D. 乙和甲、乙和丁所能形成的化合物都是剧毒物质
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上月考五化学卷(解析版) 题型:选择题
下列坐标图均涉及平衡原理,其中相关表述正确的是

A.图①表示室温下,用0.1mol·L-1氨水吸收HCl气体时,溶液的粒子浓度随吸收HCl的变化,实线表示c(NH3·H2O),虚线表示c(NH4+),处于M点时溶液呈中性
B.图②表示2SO2(g)+O2(g)  2SO3(g) △H<0正逆反应的平衡常数K随温度的变化
2SO3(g) △H<0正逆反应的平衡常数K随温度的变化
C.图③表示反应2NH3(g)  3H2(g)+N2(g)在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系
3H2(g)+N2(g)在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系
D.图④表示AgCl(s)  Ag+(
Ag+( aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处
aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处
查看答案和解析>>
科目:高中化学 来源:2016-2017黑龙江牡丹江第一高级中学高二上期末化学卷(解析版) 题型:填空题
依据反应:2Ag+(aq)+Cu(s)=Cu2+ (aq)+2Ag(s)设计的原电池如下图所示。
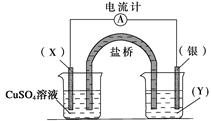
请回答下列问题:
(1)电极X的材料是___________,电解质溶液Y是___________;
(2)银电极为电池的___________极,发生的电极反应为_________;X电极上发生的电极反应为___________。
(3)外电路中的电子是从___________电极流向_________电极。
(4)硫酸铜溶液PH<7 的原因是 (用离子方程式解释)
的原因是 (用离子方程式解释)
查看答案和解析>>
科目:高中化学 来源:2016-2017黑龙江牡丹江第一高级中学高二上期末化学卷(解析版) 题型:选择题
各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )

A.②①③④ B.④③①② C.④②①③ D.③②④①
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二12月月考化学卷(解析版) 题型:计算题
常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
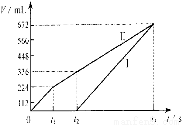
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的c(H+)。
(3)电解至t3时,消耗水的质量。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三上考试化学试卷(解析版) 题型:选择题
常温下,将pH=11的X、Y两种碱溶液,分别从1 mL稀释至100 mL,其pH与溶液体积(V)的变化关系如图,下列说法正确的是

A.稀释前,X、Y中溶质碱的物质的量浓度相等
B.稀释后,X溶液的碱性比Y溶液的碱性强
C.同浓度盐酸分别与X、Y这两种碱溶液恰好完全反应时,消耗盐酸的体积V(X)>V(Y)
D.若a>9,则X和Y都为弱碱溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com