

 .
.分析 由合成路线可知,反应①为光照条件下的取代反应,反应②为NaOH/醇条件下的消去反应生成A为 ,A发生反应③为烯烃与氯气加成生成B为
,A发生反应③为烯烃与氯气加成生成B为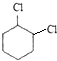 ,B发生反应④得到两个C=C键,则为NaOH/醇条件下的消去反应,反应⑤为溴与环已二烯的1,4加成反应,反应⑥为烯烃与氢气的加成反应,生成C为
,B发生反应④得到两个C=C键,则为NaOH/醇条件下的消去反应,反应⑤为溴与环已二烯的1,4加成反应,反应⑥为烯烃与氢气的加成反应,生成C为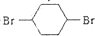 ,反应⑦NaOH/水条件下的水解反应生成对环己二醇,据此答题.
,反应⑦NaOH/水条件下的水解反应生成对环己二醇,据此答题.
解答 解:由合成路线可知,反应①为光照条件下的取代反应,反应②为NaOH/醇条件下的消去反应生成A为 ,A发生反应③为烯烃与氯气加成生成B为
,A发生反应③为烯烃与氯气加成生成B为 ,B发生反应④得到两个C=C键,则为NaOH/醇条件下的消去反应,反应⑤为溴与环已二烯的1,4加成反应,反应⑥为烯烃与氢气的加成反应,生成C为
,B发生反应④得到两个C=C键,则为NaOH/醇条件下的消去反应,反应⑤为溴与环已二烯的1,4加成反应,反应⑥为烯烃与氢气的加成反应,生成C为 ,反应⑦NaOH/水条件下的水解反应生成对环己二醇,
,反应⑦NaOH/水条件下的水解反应生成对环己二醇,
(1)A为 ,故答案为:
,故答案为: ;
;
(2)根据上面的分析可知,②的反应类型是消去反应,故答案为:消去反应;
(3)根据上面的分析可知,上述七个反应中属于加成反应的有③⑤⑥,故答案为:③⑤⑥;
(4)A为 ,A中所含有的官能团名称为碳碳双键,故答案为:碳碳双键.
,A中所含有的官能团名称为碳碳双键,故答案为:碳碳双键.
点评 本题考查有机物的合成,题目难度不大,注意把握有机物的官能团与性质的关系即可解答,明确反应条件与反应类型的关系是解答的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2/mol•L-1 | 0.010 | 0.020 | 0.020 |
| c(I2)/mol•L-1 | 0.010 | 0.010 | 0.020 |
| A. | 平衡时甲中和丙中H2的转化率相同 | |
| B. | 平衡时乙中I2的转化率小于40% | |
| C. | 平衡时乙中c(HI)比甲中的2倍大 | |
| D. | 反应平衡时,丙中气体颜色最深,乙中气体颜色最浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -44.2kJ/mol | B. | +44.2kJ/mol | C. | -330kJ/mol | D. | +330kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 A.如图表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化 A.如图表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化 |  B.如图表示 0.1mol MgCl2•6H2O在空气中充分加热时固体质量随时间的变化 B.如图表示 0.1mol MgCl2•6H2O在空气中充分加热时固体质量随时间的变化 |  C.如图表示分别稀释10mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100 C.如图表示分别稀释10mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100 |  D.如图表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 D.如图表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制稀盐酸用量筒量取浓盐酸时,俯视刻度线 | |
| B. | 用量筒量取所需的浓盐酸倒入烧杯后,再用水洗量筒 2~3 次,洗液倒入烧杯中 | |
| C. | 称量 11.7 g NaCl 配制 0.2 mol/L NaCl 溶液时,砝码错放在左盘 | |
| D. | 定容时仰视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的摩尔质量是 35.5g/mol | B. | 98g H2SO4中含氧原子个数为NA | ||
| C. | 含NA个氢原子的H2O的质量是18 g | D. | 22.4 L 氦气的质量是 4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E是中学化学常见的5种化合物,其中A、B是氧化物.单质X、Y是生活中常见的金属,相关物质间的转化关系如图所示(部分反应物与产物已略去):
A、B、C、D、E是中学化学常见的5种化合物,其中A、B是氧化物.单质X、Y是生活中常见的金属,相关物质间的转化关系如图所示(部分反应物与产物已略去):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com