
2014年5月7日南京某建设公司丢失用于材料探伤的放射源Ir—192(铱—192)一枚,经相关部门的努力追查,丢失的放射源于5月10日被回收,Ir—192的放射性会对人体产生很大的伤害。已知Ir元素位于周期表中第6周期第Ⅷ族,原子序数为77,192为该核素的质量数,下列关于Ir—192的说法正确的是( )
A.Ir—192核外含有115个电子 B.Ir为非金属元素
C.Ir—192中子数与质子数的差为38 D.Ir元素与碘元素位于同一周期
科目:高中化学 来源:2013-2014河北省保定市第二学期期中考试高一化学试卷(解析版) 题型:选择题
下列叙述表示可逆反应N2 + 3H2  2NH3一定处于平衡状态的是……… ( )
2NH3一定处于平衡状态的是……… ( )
A.N2、H2、NH3的百分含量相等 B.3v(N2)正= v(H2)逆
C.定容容器中,气体的密度不变 D.N2、H2、NH3的浓度之比为1:3:2
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是 ( )
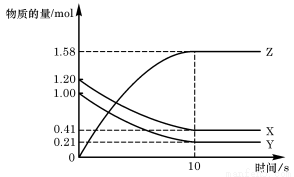
A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B.反应开始到10s, X的物质的量浓度减少了0.79mol/L
C.反应开始时10s, Y的转化率为79.0%
D.反应的化学方程式为:X(g)+ Y(g) Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:选择题
反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,由此可判断( )
C(g)+D(g)过程中的能量变化如图所示,由此可判断( )
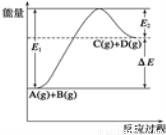
A.1molA与1molB充分反应后,能量变化为ΔE
B.加入催化剂后,反应加快,ΔE减小
C.反应物的总键能小于生成物的总键能
D.反应达到平衡时,升高温度,A的转化率增大
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:选择题
下图是元素周期表前四周期的一部分,关于元素R、W、X、Y、Z的叙述正确的是( )

A.最高价氧化物的水化物的酸性:W>Y
B.Z的单质常温下是液体,所在的周期中含有32种元素
C.Z的原子序数比R大17
D.氢化物的沸点:X<Z
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高三4月联考理综化学试卷(解析版) 题型:填空题
(14分)近几年来,我国中东部地区陷入严重的雾霾天气,面对全球近期的气候异常,环境问题再次成为焦点。非金属氧化物的合理控制和治理是优化我们生存环境的有效途径之一。请运用化学反应原理知识,回答下列问题:
Ⅰ、目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-57kJ?mol-1
②4CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
③H2O(g)=H2O(l) △H=-44.0kJ?mol-1
写出CH4(g)与NO2(g)反应生成N2(g),CO2(g)和H2O(l)的热化学方程式________________。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+ 2NO(g) N2(g)+CO2(g)某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度(mol/L) 时间(min) | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①T℃时该反应的平衡常数为____________(结果保留两位有效数字)。
②30 min后改变某一条件,反应重新达到平衡,则改变的条件可能是___________________。
③若30min后升高温度重新达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应
△H_________0(填“<”“>”“=”)。
Ⅱ、某科研小组为治理SO2对大气的污染,利用烟气中的SO2为原料制取硫酸。
(1)利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式__________。
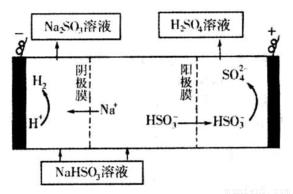
(2)利用Na2SO3溶液充分吸收SO2制得NaHSO3溶液。
①常温时吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
以下离子浓度关系的判断正确的是
A.NaHSO3溶液中c(H+)<c (OH-)
B.Na2SO3溶液中c(Na+)>c (SO32-)>c (HSO3-)>c (OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c (HSO3-)>c (SO32-)>c(OH-)=c(H+)
D.当n(SO32-):n(HSO3-)=1:1时,c(Na+)=c (HSO3-)+2c (SO32-)
②然后电解该NaHSO3溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式______________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高三4月联考理综化学试卷(解析版) 题型:选择题
有关物质的转化关系如下图所示(部分物质和条件已省去),C、X均是单质,H溶液呈浅绿色,I溶液呈棕黄色。下列有关判断正确的是

A. X固体可能是碘单质
B. 图中所示反应均为氧化还原反应
C. 1mol C与E溶液完全反应转移电子数为NA(NA为阿伏加德罗常数)
D. E、H、I溶液配制时,均需加酸防止其水解
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省协作体高三第二次联考理综化学试卷(解析版) 题型:填空题
【化学—选修2:化学与技术】(15分)
化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
Ⅰ.氮的化合物是重要的化工产品。其生产方法也在逐渐改进中,各国科学家均在为提高其产量,降低能耗做各种有益的探究。
(1)25℃时合成氨反应热化学方程式为:N2(g)+3H2(g)==2NH3(g),ΔH=-92.4kJ/mol 。 在该温度时,取1molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ。其原因是_________________________________。
(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是 ;与传统的合成氨的方法比较,该方法的优点是 。
Ⅱ.(3)卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
d.将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
e.电解熔融的氯化镁可得到Mg。
①步骤d中的“一定条件”指的是 。
②有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,你同意该同学的想法吗?为什么?
(4) 铀是核反应最重要的燃料,已经研制成功一种螫合型离子交换树脂,它专门吸附海水中 的U4+,而不吸附其他元素。其反应原理为 (树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省南昌市高二下学期期末考试化学试卷(解析版) 题型:填空题
(12分)对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(1)现有下列6种物质:SO2,SiO2,CaO,MgO,Fe2O3,Na2O2按照不同的分类标准,它们中有一种物质与其他5种有明显的不同,请找出这种物质,并写出依据(写出两种分类方法):
①___________________________________________________;
②___________________________________________________。
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1mol/L的FeCl3溶液,可制得一种红褐色胶体。
①反应的化学方程式为_________________________________。
②如何用较简单的方法判断胶体是否制备成功?___________________________________。
(3)若向该胶体中加入饱和(NH4)2SO4溶液,发生的现象是_________________________;
原因是_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com