
【题目】钠与下列物质反应都能够产生氢气:①H2O;②CH3COOH;③CH3CH2OH,从产生氢气的剧烈程度可推断出这三种物质产生H+的难易程度是(从难到易的顺序)( )
A. ①②③ B. ②③① C. ③①② D. ②①③
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下, ![]() 溶液发生催化分解。不同时刻测得生成
溶液发生催化分解。不同时刻测得生成![]() 的体积(已折算为标准状况)如下表。
的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A. ![]() 的平均反应速率:
的平均反应速率: ![]()
B. ![]() 的平均反应速率:
的平均反应速率: ![]()
C. 反应到![]() 时,
时, ![]()
D. 反应到![]() 时,
时, ![]() 分解了50%
分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两容器都在进行A→B的反应,甲容器内每分钟减少了4molA,乙容器内每分钟减少了2molA,则甲容器内的反应速率比乙容器内的反应速率要( )
A.快B.慢C.相等D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对10mL1mol/L的盐酸与一小块大理石的化学反应CaCO3+2HCl=CaCl2+CO2↑+H2O,下列措施能使化学反应速率提高的是( )
A.降低温度B.增加大理石的量
C.增加盐酸的浓度D.加入5mLH2O
查看答案和解析>>
科目:高中化学 来源: 题型:
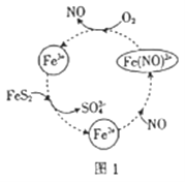
【题目】黄铁矿(主要成分为FeS2)的有效利用对环境具有重要意义。
(1)在酸性条件下催化氧化黄铁矿的物质转化关系如图1所示。
①图1转化过程的总反应中,FeS2作__________(填“催化剂”“氧化剂”或“还原剂”,下同)。该转化过程中NO的作用是________。
②写出图1中Fe3+与FeS2反应的离子方程式:________________________。
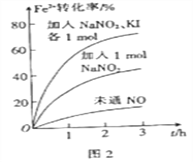
(2)FeS2氧化为Fe3+的过程中,控制起始时Fe2+的浓度、溶液体积和通入O2的速率不变,改变其他条件时,Fe2+被氧化的转化率随时间的变化如图2所示。
①加入NaNO2发生反应:2H++3NO2-=NO3-+2NO↑+H2O。该反应中若有6molNaNO2完全反应,转移电子的物质的量为________mol。
②加入NaNO2、KI发生反应:4H++2NO2-+2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将 2 mol SO2 和 1 mol O2 充入一定容密闭容器中,在催化剂存在下进行下列反应: 2SO2(g)+ O2(g) ![]() 2SO3(g);下列说法一定表明反应达到平衡状态的是( )
2SO3(g);下列说法一定表明反应达到平衡状态的是( )
A. 生成 SO3 为2 mol
B. SO3的生成速率等于2倍 O2的生成速率
C. SO2 和 SO3 物质的量之和为 2mol
D. 气体的密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1mol/L二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() 随pH的变化如图所示已知[
随pH的变化如图所示已知[![]() ]。
]。

下列叙述错误的是
A. lg[K2(H2A)]=-4.2
B. pH=4.2时,c(HA-) = c(A2-) = c(H+)
C. pH=2.7时,c(HA-)>c(H2A)= c(A2-)
D. pH=1.2时,c(H2A)=c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12。
(1)该温度下,水的离子积常数Kw=________________。
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=_________,此时该溶液中由水电离的c(OH-)=____________。
(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com