
【题目】在一定温度下,1 mol CO和2 mol H2O通入一个密闭容器中:CO(g)+H2O (g)![]() CO2(g)+H2(g),一定时间后达到平衡,此时,CO的含量为p%,若维持温度不变,改变起始加入物质的物质的量,平衡时CO的含量仍为p%的是( )
CO2(g)+H2(g),一定时间后达到平衡,此时,CO的含量为p%,若维持温度不变,改变起始加入物质的物质的量,平衡时CO的含量仍为p%的是( )
A.1 mol CO2、2 mol H2B.0.2 mol CO2、0.2 mol H2、0.8 mol CO、1.8 mol H2O
C.1 mol CO2、1 mol H2OD.1 mol CO2、 1 mol H2、 2 mol H2O
【答案】B
【解析】
维持温度不变,改变起始加入物质的物质的量,平衡时CO的含量仍为p%,说明二者互为等效平衡,该反应为气体等体积反应,“一边倒”后,需满足n(CO):n(H2O)=1:2即可。
A、1 mol CO2、2 mol H2转化到左边,得到n(CO)=1mol、n(H2O)=1mol、n(H2)=1mol,与原平衡不等效,故A不符合;
B、0.2 mol CO2、0.2 mol H2、0.8 mol CO、1.8 mol H2O转化到左边,得到n(CO)=1mol、n(H2O)=2mol,与原平衡完全等效,故B符合;
C、CO2与H2O充入后不能发生CO(g)+H2O (g)![]() CO2(g)+H2(g),故C不符合;
CO2(g)+H2(g),故C不符合;
D、1 mol CO2、 1 mol H2、 2 mol H2O转化到左边,得到n(CO)=1mol、n(H2O)=3mol,与原平衡不等效,故D不符合;
答案选B。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】苯氧乙醇是护肤产品中常用的一种有机物,下图是利用烃M和苯酚为主要原料制备苯氧乙醇的合成路线,请回答相关问题。
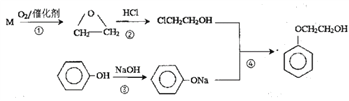
(1)反应①中M与氧气的物质的量之比为2:1且原子利用率为100%,则M的结构简式是_______________,反应①的反应类型是___________________。
(2)ClCH2CH2OH的名称是_____________________。
(3)苯氧乙醇中含有的官能团是___________________,分子式是___________________。
(4)苯酚除了与氢氧化钠反应外也可以与碳酸钠反应生成苯酚钠,该反应的化学方程式是_____________
(5)苯氧乙醇的同分异构体中符合下列要求的有__________种(不考虑一个碳原子上连两个羟基的情况)。
a.属于芳香化合物且苯环上有奇数个取代基
b.能与钠反应生成氢气且只含有一种官能团
其中核磁共振氢谱中峰的数目最少的结构简式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有物质的量浓度均为0.1molL-1的①NH4Cl溶液,②NaCl溶液,③HCl溶液各20mL,下列说法错误的是( )
A.三种溶液中c(Cl-)的关系是①=②=③
B.若将三种溶液稀释相同的倍数,pH变化最小的是②
C.三种溶液中由水电离出的c(H+)的关系是①<②<③
D.若向三种溶液中分别加入20mL0.1molL-1的NaOH溶液后,pH最小的是③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-ΔΗ>0,下列叙述正确的是( )
H++OH-ΔΗ>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体NaOH,平衡逆向移动,c(OH-)降低
D.向水中加入少量固体NaCl,pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z的原子序数依次增大,R和Y位于同主族,R-和Y+的简单离子相差8个电子。甲、乙化合物均含上述四种元素;常温下,0.01molL-1甲溶液的pH=2,0.01molL-1乙溶液的pH=a(2<a<7)。向乙溶液中滴加甲溶液,产生气体的物质的量与甲的物质的量关系如图所示(假设气体全部排出)。下列说法不正确的是( )
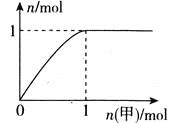
A.简单的离子半径:Z>X>Y
B.简单气态氢化物的热稳定性:X>Z
C.甲、乙中均含有离子键和共价键
D.常温下,甲、乙溶液中由水电离出的H+和OH-之间存在:c(H+)水c(OH-)水=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有H2RO4=H++HRO4-、HRO4-H++RO42-,现有物质的量浓度都为0.1molL-1的三种溶液:①NaHRO4溶液;②H2RO4溶液;③Na2RO4溶液。下列说法中正确的是( )
A.②和③等体积混合后的溶液中:c(Na+)=c(HRO4-)+c(H2RO4)+c(RO42-)
B.100mL①溶液中:n(HRO4-)+n(RO42-)+n(OH-) -n(H+)=0.01mol
C.①和②等体积混合后的溶液中离子浓度大小顺序为c(H+)>c(HRO4-)>c(Na+)
D.若①和③等体积混合后,会抑制水的电离,则HRO4-的电离程度肯定大于RO42-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1mol·L-1NaA溶液中通人HC1气体,溶液的pH随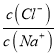 变化的关系如图所示。忽略溶液体积变化,下列有关说法不正确的是
变化的关系如图所示。忽略溶液体积变化,下列有关说法不正确的是
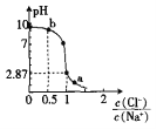
A.水的电离程度:b>a
B.a点溶液中:c(Na+)+c(H+)=c(Cl-)+c(A-)+c(OH-)
C.b点溶液中:c(A-)+2c(H+)=c(HA)+2c(OH-)
D.Ka(HA)的数量级为l0-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼是动植物所必须的微量元素,其单质和化合物广泛应用于冶金、机械、化工、核工业、医药、农业等部门。利用硼镁矿(主要成分为Mg2B2O3·5H2O)制取制硼酸、金属镁及粗硼的工艺流程图如下:
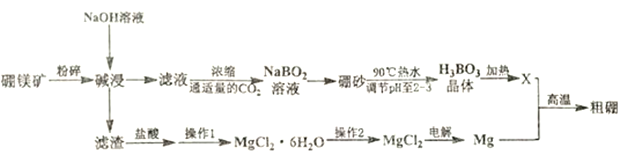
已知:①硼砂为Na2B4O7·10H2O
②硼酸(H3BO3)是一种可溶于水的一元弱酸,与过量的NaOH反应生成Na[B(OH)4]
③硼酸在不同温度下的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
溶解度(g/100g水) | 3 | 3 | 5 | 7 | 9 | 11 | 15 | 18 | 23 | 29 |
(1)粉碎硼铁矿的目的是:______________;Mg2B2O5·H2O中B的化合价为:______价。
(2)滤渣的主要成分是: ________
(3)硼酸的电子式: ________;写出硼酸在水中电离的方程式: ________________;
(4)X为硼酸晶体加热完全脱水后的产物,其与Mg反应制取粗硼的化学方程式为: ________;
(5)硼砂溶于90℃热水后,常用稀硫酸调pH至2~3(酸性)制取HBO3晶体,该反应的离子方程式为: ________________;从上述溶液中获得H3BO3晶体的操作: ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A.铁和稀硫酸反应:2Fe + 6H+= 2Fe3+ +3H2↑
B.NaHCO3溶液与NaOH溶液反应: OH- + HCO![]() = H2O + CO
= H2O + CO![]()
C.钠和水反应: Na+2H2O = Na++2OH-+H2↑
D.Fe2+和Cl2的反应:Fe2++ Cl2 = Fe3++ 2Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com