
| n |
| V |
| 2.24L |
| 22.4L/mol |
| 0.25mol |
| 0.1 L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、甲烷的电子式 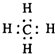 | ||
B、氟化钠的电子式 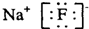 | ||
| C、硫离子的核外电子排布式 1s22s22p63s23p4 | ||
D、碳-12原子
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、需要加热才能发生的反应是吸热反应 |
| B、等量的金刚石和石墨固体分别完全燃烧,前者放出热量多,说明金刚石更稳定 |
| C、化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |
| D、由热化学方程式 3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol可知,1molN2与3molH2放入密闭容器中,在催化剂的作用下反应得到氨气,将释放92kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 改变条件 | 新平衡与原平衡比较 | |
| A | 增大压强 | N2的浓度一定变小 |
| B | 升高温度 | N2的转化率变小 |
| C | 充入一定量H2 | H2的转化率不变,N2的转化率变大 |
| D | 使用适当催化剂 | NH3的体积分数增大 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 操 作 | 现 象 |
I |
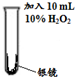 |
剧烈反应,有大量无色气体产生,该气体可以使带火星的木条复燃;反应停止后,试管内壁上的银全部溶解,得到澄清液体a. |
| 实验编号 | 操 作 | 现 象 |
Ⅱ |
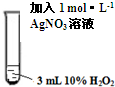 |
振荡,溶液无明显现象. |
Ⅲ |
 |
剧烈反应,产生大量无色气体,同时在试管底部仍有少量黑色固体. |
| 实验步骤和操作 | 实验现象及结论 |
| 取3mL 10% H2O2在试管中,加入少量Ag2O,充分反应后, |
查看答案和解析>>
科目:高中化学 来源: 题型:
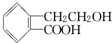 ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质.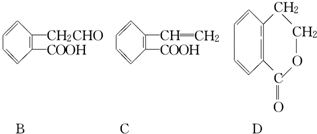
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com