
| A. | pH=2的溶液:HCO3-、Na+、ClO-、NO3- | |
| B. | 无色溶液中可能大量存在:Al3+、NH4+、Cl-、S2- | |
| C. | 水电离出的c(H+)=10-4 mol/L的溶液:Na+、K+、SO42-、CO32- | |
| D. | 使石蕊呈红色的溶液:NH4+、NO3-、AlO2-、I- |
分析 A.pH=2的溶液中存在大量氢离子,碳酸氢根离子、次氯酸根离子与氢离子反应;
B.铝离子与硫离子发生双水解反应;
C.水电离出的c(H+)=10-4 mol/L的溶液中存在大量氢离子或氢氧根离子,四种离子不与氢氧根离子反应;
D.使石蕊呈红色的溶液中才大量氢离子,偏铝酸根离子与氢离子反应,硝酸根离子在酸性条件下能够氧化碘离子.
解答 解:A.pH=2的溶液呈酸性,溶液中存在大量氢离子,HCO3-、ClO-与氢离子反应,在溶液中不能大量共存,故A错误;
B.Al3+、S2-之间发生双水解反应,在溶液中不能大量共存,故B错误;
C.水电离出的c(H+)=10-4 mol/L的呈酸性或碱性,之间不反应,都不与氢氧根离子反应,在碱性溶液中能够大量共存,故C正确;
D.使石蕊呈红色的溶液呈酸性,溶液中存在大量氢离子,AlO2-与氢离子反应,酸性条件下NO3-、I-发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:选择题
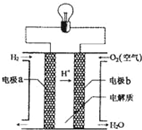 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )| A. | 该电池工作时电能转化为化学能 | |
| B. | 该电池中电极a是正极 | |
| C. | 外电路中电子由电极a通过导线流向电极b | |
| D. | 该电池的总反应:H2+O2═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向H2SO4溶液中滴加Ba(OH)2溶液 | B. | 向NaOH溶液中通入CO2 | ||
| C. | 向滴有酚酞的NaOH溶液中滴加盐酸 | D. | 将(NH4)2SO4和熟石灰混合研磨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮的非金属性比磷强,所以氮气的性质比白磷活泼 | |
| B. | ⅦA族元素一定是同周期中非金属性最强的元素 | |
| C. | IA族元素的金属性一定比IIA族元素的金属性强 | |
| D. | Na+半径大于Cl-半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
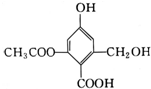
| A. | X的化学式为C10H10O6 | |
| B. | X在一定条件下能与FeCl3溶液发生显色反应 | |
| C. | X在一定条件下能发生消去反应和酯化反应 | |
| D. | 1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗的物质的量分别为3 mol、4 mol、1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的无色溶液中:$Na_{\;}^+$、$Cu_{\;}^{2+}$、$Cl_{\;}^-$、$CO_3^{2-}$ | |
| B. | 0.1 mol•L-1 AlCl3溶液中:$Cu_{\;}^{2+}$、$Mg_{\;}^{2+}$、$SO_4^{2-}$、$NO_3^-$ | |
| C. | 由水电离产生的c(H+)=10-12 mol•L-1的溶液中:$NH_4^+$、$SO_4^{2-}$、$HCO_3^-$、$Cl_{\;}^-$ | |
| D. | 0.1 mol•L-1 KSCN溶液中:$Fe_{\;}^{3+}$、$NH_4^+$、$Br_{\;}^-$、$SO_4^{2-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com