
某温度下,在体积为2 L的密闭容器中,充入1 mol 气体A和a mol气体B,发生如下反应:A(g)+B(g)2C(g)。5 min 后反应达到平衡时n(A)为0.4 mol。在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如图所示。下列叙述正确的是(双选)( )
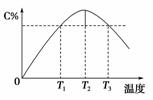
A.0~5 min,C物质的平均反应速率为0.12 mol·L-1·min-1
B.图中T1时正反应速率等于T3时正反应速率
C.该反应T2时的平衡常数大于T3时的平衡常数
D.图中T2时,若只增大压强,则正、逆反应速率不改变
科目:高中化学 来源: 题型:
一定条件下,通过下列反应可实 现燃煤烟气中硫的回收:
现燃煤烟气中硫的回收:
SO2(g)+2CO(g) 2CO2(g)+S(l) ΔH<0
2CO2(g)+S(l) ΔH<0
若反应在恒容的密闭容器中 进行,下列有关说法正确的是( )
进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期元素在周期表中的位置如图,其中只有M元素原子最外层电子数与电子层数相等。下列说法不正确的是( )。

A.原子半径:Z<M
B.Y的最高价氧化物对应水化物的酸性比X的弱
C.非金属性:X<Z
D.M元素最高价氧化物对应水化物具有两性
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温常压下,已知:
①4Fe(s)+3O2(g)===2Fe2O3(s) ΔH1
②4Al(s)+3O2(g)===2Al2O3(s) ΔH2
③2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系正确的是( )
A.ΔH3= (ΔH1+ΔH2) B.ΔH3=ΔH2-ΔH1
(ΔH1+ΔH2) B.ΔH3=ΔH2-ΔH1
C.ΔH3=2(ΔH1+ΔH2) D.ΔH3= (ΔH2-ΔH1)
(ΔH2-ΔH1)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:H2(g)+I2(g)2HI(g) ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
( )
A.甲、乙提高相同温度
B.甲中加入0.1 mol He,乙不变
C.甲降低温度,乙不变
D.甲增加0.1 mol H2,乙增加0.1 mol I2
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气用途十分广泛,可用于生产半导体材料硅,其生产的流程如下,下列说法不正确的是( )石英砂 粗硅
粗硅 四氯化硅
四氯化硅 纯硅.
纯硅.
|
| A. | ①③是置换反应,②是化合反应 |
|
| B. | 高温下,焦炭与氢气的还原性均强于硅 |
|
| C. | 任一反应中,每消耗或生成28 g硅,均转移4 mol电子 |
|
| D. | 如果焦炭不足,反应①会释放CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式中,正确的是( )
|
| A. | Na2SO4=2Na++SO4﹣2 |
|
| B. | Ba(OH)2⇌Ba2++2OH﹣ |
|
| C. | NaHCO3=Na++H++CO32﹣ |
|
| D. | NH4Fe(SO4)2=NH4++Fe3++2SO42﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为( )
|
| A. | 10mol | B. | 11mol | C. | 12mol | D. | 13mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
写出下列方程式:
(1)丙烯与溴化氢反应(只写主要产物) .
(2)2﹣甲基﹣1,3﹣丁二烯与等量的溴水反应(只写主要产物) .
(3)甲苯与溴蒸汽在光照条件下反应生成一溴代物 r .
(4)实验室制取TNT的反应式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com