
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+ )=c(OH- )+c(A- ) | |
| B. | 25℃时,pH=4.7浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液中:(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) | |
| C. | 氢硫酸的酸性比碳酸弱,则NaHS溶液中:c(Na+)>c(HS-)>c(H+)>c(OH-) | |
| D. | ①0.2mol•L-1NH4Cl溶液②0.1mol•L-1(NH4)2Fe(SO4)2溶液③0.2mol•L-1NH4HSO4溶液④0.1mol•L-1(NH4)2CO3溶液中,c(NH4+ )大小:③>②>①>④ |
分析 A、据电荷守恒分析;
B、pH=4.7、浓度均为0.1mol•L-1的CH3COOH和CH3COONa的混合溶液中依据电荷守恒分析判断;
C、氢硫酸的K1、K2均比碳酸的小,则NaHS溶液呈碱性,根据溶液的酸碱性判断;
D、①铵根离子水解,②铵根离子和亚铁离子水解相互抑制,③电离出氢离子抑制铵根离子水解,④铵根离子和碳酸根离子发生互促水解,铵离子水解程度越大,溶液中的铵离子浓度越小,以此解答该题.
解答 解:A、pH=2的HA溶液与pH=12的MOH溶液任意比混合,溶液中只有4种离子,据电荷守恒有c(H+)+c(M+ )=c(OH- )+c(A- ),故A正确;
B、pH=4.7、浓度均为0.1mol•L-1的CH3COOH和CH3COONa的混合溶液中存在电荷守恒,c(CH3COO-)+c(OH-)=c(Na+)+c(H+),醋酸电离程度大于醋酸根离子水解程度,溶液中c(CH3COOH)<c(Na+),c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故B正确;
C、氢硫酸的K1、K2均比碳酸的小,所以氢硫酸是弱酸,则NaHS是强碱弱酸酸式盐,其溶液呈碱性,所以c(OH-)>c(H+),故C错误;
D、①0.2mol•L-1NH4Cl溶液中铵离子正常水解,浓度小于0.2mol/L;
②(NH4)2Fe(SO4)2,铵根离子和铁离子水解相互抑制,铵根离子浓度大于①;
③NH4HSO4溶液的氢离子抑制了铵离子水解,铵根离子浓度大于②,
④(NH4)2CO3,碳酸根离子与铵离子水解相互促进,铵离子浓度减小于①;c(NH4+ )大小:③>②>①>④,故D正确;
故选C.
点评 本题考查离子浓度大小的比较,根据物料守恒、电荷守恒、盐类水解的影响因素及溶液的酸碱性来分析解答,难度中等.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
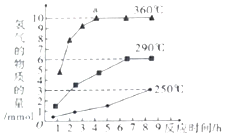 磷元素是生命体中重要的元素之一
磷元素是生命体中重要的元素之一查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A2-)>c(H2A) | B. | c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-) | ||
| C. | c(Na+)=c( HA-)+c(H2A) | D. | c(H+)=c(A2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2能使FeCl3、酸性KMnO4溶液迅速褪色 | |
| B. | 可以用澄清石灰水来鉴别SO2与CO2 | |
| C. | 氨气和酸相遇都能产生白色烟雾 | |
| D. | 在反应NH3++H+=NH4+中,氨失去电子被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
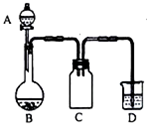 实验室一般用回收的粗铜屑(含少量的Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4•5H2O晶体,反应可在如图所示装置中进行,回答下列问题:
实验室一般用回收的粗铜屑(含少量的Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4•5H2O晶体,反应可在如图所示装置中进行,回答下列问题:| 实验一 证明H2S是弱酸 | 实验操作 | 取VmL未知浓度的H2S溶液,测其pH值为a,再向溶液中加入适量的无水CuSO4粉末,充分反应后再测其pH值为b,用过滤器将溶液中的不容物滤出,并用蒸馏水洗涤不容物,洗净,晾干并称量质量为m克. |
| 分析及结论 | 由实验中的数据可求得H2S溶液的物质的量浓度为:$\frac{1000m}{96V}$mol•L-1; 通过比较a和b数值的大小(或a>b)说明氢硫酸是弱酸. | |
| 实验原理 | 写出上述实验的化学反应方程式:CuSO4+H2S═CuS↓+H2SO4 | |
| 实验二 证明H2S是二元酸 | 实验操作 | 用已知浓度的NaOH溶液去滴定上述H2S溶液 |
| 分析及结论 | 通过实验若得出2n(H2S)=n(NaOH)(或消耗n(NaOH)为n(H2S)的二倍)即可说明H2S是二元酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 用pH试纸测定等浓度的HCl、H2SO4两溶液的pH | 测定HCl溶液的pH试纸更红 | 非金属性Cl>S |
| B | 将AgCl和AgBr的饱和溶液等体积混合 | 出现淡黄色沉淀 | Ksp(AgBr)<Ksp(AgCl) |
| C | 向Al2(SO4)3溶液中滴加过量氢氧化钡溶液 | 生成白色沉淀 | A l(OH)3 不溶于氢氧化钡溶液 |
| D | 将Fe(NO3)2 样品溶于稀硫酸,滴加KSCN溶液 | 溶液变红 | Fe(NO3)3 样品溶于稀硫酸前已氧化变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
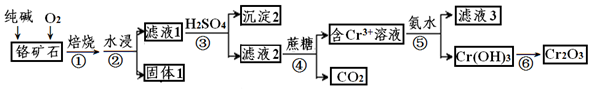
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
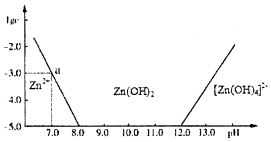 锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.| C(HCl)/(mol•L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| C(PbCl2)/(mol•L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com