
(14分) 金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下:

已知,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1) A和B两溶液混合产生白色沉淀,该白色沉淀的化学式
(2) C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质的电子式
(3)完成铝在碱性条件下与NO3-反应的离子方程式 。
(4)过量D的水溶液与A溶液反应的离子方程式是 。
(5)D→C反应的化学方程式是 。
(6)除去气体C中的杂质气体E的化学方法: (用化学方程式表示)
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 。
(1)Al(OH)3 (2分)(2)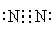 (2分)
(2分)
(3)8Al + 3NO3-+ 5OH-+ 2H2O=8AlO2-+3NH3↑(2分)
(4)3NH3·H2O+ Al3+ == Al(OH)3↓+3 NH4+ (2分)
(5)4 NH3
+5O2 4NO + 6 H2O (2分)
4NO + 6 H2O (2分)
(6)3NO2 + H2O == 2HNO3 + NO (2分)
(7)1:1 (2分)
【解析】(1)在酸性溶液中铝被氧化生成Al3+,在碱性溶液中被氧化生成AlO2-。所以A、B混合后会生成氢氧化铝沉淀,方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓。
(2)在酸性溶液中NO3-被还原生成NO,在碱性溶液中被还原生成氨气,因为在化合物中N元素的化合价分别为+2价和-3价,可发生氧化还原反应生成氮气。
(3)由以上分析可知铝在碱性条件下与NO3-反应的离子方程式为8Al + 3NO3-+ 5OH-+ 2H2O=8AlO2-+3NH3↑。
(4)氨水属于弱碱,即使过量也不能溶解氢氧化铝,方程式为3NH3·H2O+ Al3+ == Al(OH)3↓+3 NH4+ 。
(5)D生成C属于氨的催化氧化,方程式为4 NH3 +5O2 4NO + 6 H2O。
4NO + 6 H2O。
(6)NO难溶于水,NO2溶于生成NO,所以除去NO中混有的NO2的方法是通入水中,方程式为3NO2 + H2O == 2HNO3 + NO。
(7)在反应中铝失去3个电子,NO3-的还原产物是NO,化合价由+5价降低到+2价,得到3个电子,依据得失电子守恒可知,Al与被还原的NO3-的物质的量之比是1:1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(14分) 金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下:
已知,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1) A和B两溶液混合产生白色沉淀,该白色沉淀的化学式
(2) C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质的电子式
(3)完成铝在碱性条件下与NO3-反应的离子方程式 。
(4)过量D的水溶液与A溶液反应的离子方程式是 。
(5)D→C反应的化学方程式是 。
(6)除去气体C中的杂质气体E的化学方法: (用化学方程式表示)
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源:2012届山西省山大附中高三3月月考理综部分(带解析) 题型:填空题
(14分)金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下: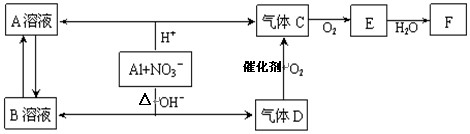
已知,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1) A和B两溶液混合产生白色沉淀,该白色沉淀的化学式
(2) C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质的电子式
(3)完成铝在碱性条件下与NO3-反应的离子方程式 。
(4)过量D的水溶液与A溶液反应的离子方程式是 。
(5)D→C反应的化学方程式是 。
(6)除去气体C中的杂质气体E的化学方法: (用化学方程式表示)
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济宁市泗水一中高二12月质量检测化学试卷(带解析) 题型:填空题
(14分)金属氢化物-镍(MH—Ni)电池由于其高能、安全、无污染、无记忆效应、价格适宜,已成为目前最具发展前景的“绿色能源”电池之一,电池总反应为MH+NiOOH  M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。
M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。
(1)写出放电时的负极反应_________________
(2)充电时,阳极的电极反应为__________________
镍氢电池正极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)x | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
查看答案和解析>>
科目:高中化学 来源:2014届山东省济宁市高二12月质量检测化学试卷(解析版) 题型:填空题
(14分)金属氢化物-镍(MH—Ni)电池由于其高能、安全、无污染、无记忆效应、价格适宜,已成为目前最具发展前景的“绿色能源”电池之一,电池总反应为MH+NiOOH  M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。
M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。
(1)写出放电时的负极反应_________________
(2)充电时,阳极的电极反应为__________________
镍氢电池正极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
|
M(OH)x |
Ksp |
pH |
|
|
开始沉淀 |
沉淀完全 |
||
|
Al(OH)3 |
1.9×10-23 |
3.43 |
4.19 |
|
Fe(OH)3 |
3.8×10-38 |
2.53 |
2.94 |
|
Ni(OH)2 |
1.6×10-14 |
7.60 |
9.75 |
回答下列问题:
(3)根据上表数据判断步骤②先析出的沉淀Ⅱ为 ,后析出的沉淀为Ⅲ为__________________(填化学式),则pH1 pH2(填填“>”、“=”或“<”),
(4)已知溶解度:NiC2O4 > NiC2O4·H2O > NiC2O4·2H2O,则③的化学方程式是 。
(5)④中阳极的电极反应为 ,验证阳极产物的试剂为 。
(6)试写出⑥的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com