

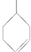
 .
.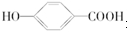 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) .
.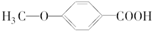 的同分异构体很多,其中符合下列条件的有3种.
的同分异构体很多,其中符合下列条件的有3种. .
. 分析 甲苯发生反应生成B,B反应生成甲基苯酚,根据甲苯和甲基苯酚结构简式及B的分子式知,甲苯与溴发生甲基对位取代反应生成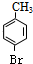 ,
, 在一定条件下发生水解反应生成
在一定条件下发生水解反应生成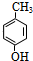 ,③的反应为取代反应,④为氧化反应、⑤为取代反应、⑥发生酯化反应生成产品,则产品的结构简式
,③的反应为取代反应,④为氧化反应、⑤为取代反应、⑥发生酯化反应生成产品,则产品的结构简式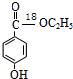 ;
; 反应生成C、C反应生成D、D反应生成
反应生成C、C反应生成D、D反应生成 ,根据高分子化合物结构简式知,D结构简式为
,根据高分子化合物结构简式知,D结构简式为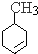 ,C发生消去反应生成D,B发生加成反应生成C,则C结构简式为
,C发生消去反应生成D,B发生加成反应生成C,则C结构简式为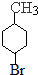 ,
,
据此分析解答.
解答 解:甲苯发生反应生成B,B反应生成甲基苯酚,根据甲苯和甲基苯酚结构简式及B的分子式知,甲苯与溴发生甲基对位取代反应生成 ,
, 在一定条件下发生水解反应生成
在一定条件下发生水解反应生成 ,③的反应为取代反应,④为氧化反应、⑤为取代反应、⑥发生酯化反应生成产品,则产品的结构简式
,③的反应为取代反应,④为氧化反应、⑤为取代反应、⑥发生酯化反应生成产品,则产品的结构简式 ;
; 反应生成C、C反应生成D、D反应生成
反应生成C、C反应生成D、D反应生成 ,根据高分子化合物结构简式知,D结构简式为
,根据高分子化合物结构简式知,D结构简式为 ,C发生消去反应生成D,B发生加成反应生成C,则C结构简式为
,C发生消去反应生成D,B发生加成反应生成C,则C结构简式为 ,
,
(1)通过以上分析知,产物的结构简式为 ,其摩尔质量为168g•mol-1,故答案为:168g•mol-1;
,其摩尔质量为168g•mol-1,故答案为:168g•mol-1;
(2)通过以上分析知,D的结构简式为 ,故答案为:
,故答案为: ;
;
(3)通过以上分析知,在①~⑥的反应中属于取代反应的有①②③⑤⑥,反应⑧为溴代烃的消去反应,需要的条件是NaOH醇溶液,加热,故答案为:①②③⑤⑥;NaOH醇溶液,加热;
(4)酚羟基和甲基都能被酸性高锰酸钾溶液氧化,则如果③④对调会导致酚羟基被氧化,
故答案为:会将酚羟基氧化;
(5) 中含有羧基、羟基,发生缩聚反应生成
中含有羧基、羟基,发生缩聚反应生成 ,反应方程式为
,反应方程式为 ,故答案为:
,故答案为: ;
;
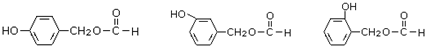
(6) 的同分异构体符合:遇到FeCl3溶液出现显色现象,说明含有酚羟基;能发生水解反应,能发生银境反应,结合结构简式可知,应含有甲酸形成的酯基,且无-CH3结构,只能含有2个取代基为-OH、-CH2OOCH,则苯环上有2种H原子,则2个不同的取代基处于邻、间、对位,所以有3种同分异构体,上述同分异构体中核磁共振氢谱显示其有5种峰的结构简式为
的同分异构体符合:遇到FeCl3溶液出现显色现象,说明含有酚羟基;能发生水解反应,能发生银境反应,结合结构简式可知,应含有甲酸形成的酯基,且无-CH3结构,只能含有2个取代基为-OH、-CH2OOCH,则苯环上有2种H原子,则2个不同的取代基处于邻、间、对位,所以有3种同分异构体,上述同分异构体中核磁共振氢谱显示其有5种峰的结构简式为 ,故答案为:3;
,故答案为:3; .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及知识综合运用能力,综合性较强,涉及物质推断、同分异构体种类书写、方程式的书写等知识点,明确物质之间的转化、官能团及其性质关系及反应条件是解本题关键,难点是同分异构体种类判断,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
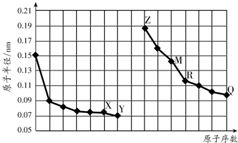
| A. | R在周期表的第15列 | |
| B. | 简单离子的半径:X>Z>M | |
| C. | Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
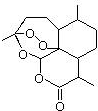
 ,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)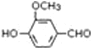 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图: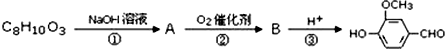
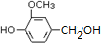 .
. .
.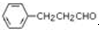 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).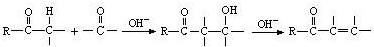
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO3-)+c(SO32-) | |
| B. | 0.1mol•L-1的KHA溶液,其PH=10:c(K+)>c(OH-)>c(HA-)>c(H+) | |
| C. | 20mL0.1mol•L-1醋酸钠溶液与10mL 0.1mol•L-1盐酸混合后的溶液中: 2 c(H+)+c(CH3COOH)=c(CH3COO-)+2 c(OH-) | |
| D. | 在25mL 0.1 mol•L-1NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液,溶液pH变化如图所示,在A、B间任一点,溶液中一定都存在下列关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)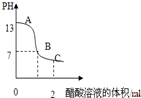 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学式 | HCOOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰用于人工降雨 | |
| B. | 蔗糖中加入浓硫酸,蔗糖变黑,体积膨胀 | |
| C. | 溶洞中钟乳石的形成 | |
| D. | 豆科作物的根瘤菌对空气中氮的固定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com