
| A. | Na2SO3溶液使酸性高锰酸钾溶液褪色:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O | |
| B. | 铵明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca 2++2HCO 3 -+2OH -=BaCO 3↓+CO 3 2- 十2H 2 O | |
| D. | 弱酸尼泊金酸( 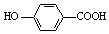 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: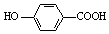 +HCO3-→ +HCO3-→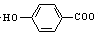 -+CO2↑+H2O -+CO2↑+H2O |
分析 A.二者发生氧化还原反应,导致酸性高锰酸钾溶液褪色;
B.氢氧化钡过量,铵根离子也参与反应;
C.氢氧化钠过量,反应生成碳酸钙、碳酸钠和水;
D.酚羟基不与碳酸氢根离子,只有羧基与碳酸氢钠反应生成而溶液和铜气体和水.
解答 解:A.Na2SO3溶液被酸性高锰酸钾溶液氧化,导致酸性高锰酸钾溶液褪色,反应的离子方程式为:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O,故A正确;
B.铵明矾溶液中加入过量的氢氧化钡溶液,铵根离子和铝离子都参与反应,正确的离子方程式为:2Ba2++NH4++Al3++2SO42-+5OH-═AlO2-+NH3•H2O+2BaSO4↓+2H2O,故B错误;
C.向碳酸氢钙溶液中加入过量氢氧化钠溶液,碳酸根离子有剩余,反应的离子方程式为:Ca2++2HCO3-+2OH -=CaCO 3↓+CO 32-+2H 2O,故C正确;
D.弱酸尼泊金酸(  )与碳酸氢钠溶液反应,酚羟基的酸性比碳酸弱,只有羧基反应,反应的离子方程式为:
)与碳酸氢钠溶液反应,酚羟基的酸性比碳酸弱,只有羧基反应,反应的离子方程式为: +HCO3-→
+HCO3-→ -+CO2↑+H2O,故D正确;
-+CO2↑+H2O,故D正确;
故选B.
点评 本题考查了离子方程式的书写方法,题目难度中等,根据反应物过量情况正确判断产物为解答关键注意熟练掌握离子方程式的书写原则,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:实验题
 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和图所示装置进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和图所示装置进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3是10电子微粒 | |
| B. | 氨气易液化,液氨可用作制冷剂 | |
| C. | 蘸有浓盐酸的玻璃棒遇氨气产生的白烟 | |
| D. | 氨气是电解质,NH3•H2O是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | W | X | Y | Z | 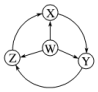 |
| A | Cl2 | FeCl2 | FeCl3 | HClx|k.Com] | |
| B | Na | Na2O2 | NaOH | NaCl | |
| C | NH3 | NO2 | HNO3 | NO | |
| D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 300 mL0.1 mol/L NaCl溶液 | |
| B. | 100 mL0.1 mol/LFeCl3溶液 | |
| C. | 标准状况下,4.48LHC1气体溶于水配成的1 L溶液 | |
| D. | 向1 L0.2 mol/L BaCl2溶液中加入0.2 mol/L的H2SO4溶液到沉淀恰好完全时的溶液(忽略溶液混合时的体积变化) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可用于水的杀菌,消毒 | |
| B. | 盐卤可用于制豆腐 | |
| C. | 目前加碘食盐主要添加的是KIO3 | |
| D. | 在空气质量日报中SO2含量属于空气污染指数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com