
|
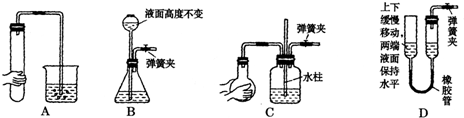
实验室有下列试剂浓H2SO4、稀H2SO4、稀HNO3、浓盐酸、含硫、磷杂质的锌粒、纯锌、CuSO4溶液,为快速制取较纯的H2,试剂的最佳选择是 | |
| [ ] | |
A. | |
B. | |
C. | |
D. | |
科目:高中化学 来源: 题型:阅读理解
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
- 2 |
- 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
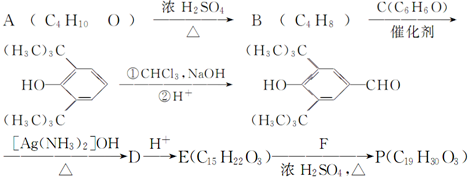
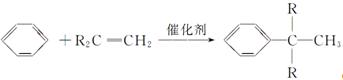 (R为烷基);
(R为烷基);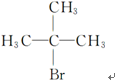

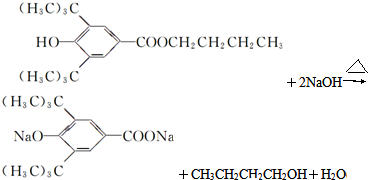

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
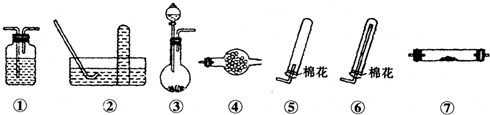
| 物质 | 熔点/℃ | 沸点℃ | 化学性质 | ||||
| S | 112.8 | 444.6 | 略 | ||||
| S2Cl2 | -77 | 137 | 遇水生成HCl,SO2,S;300℃以上完全分解; S2Cl2+Cl2
|
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2014届山西省高二下学期期中考试化学试卷(解析版) 题型:填空题
Ⅰ.2011年4月27日某市工商局查获400克袋装中老年补钙营养奶粉1 401包。这种奶粉被鉴定为所含亚硝酸盐残留量高出正常值7.8倍,长期食用可能致癌。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是_____,若有0.75 mol的还原剂被氧化,则被还原的氧化剂有_____mol。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①自来水;②淀粉碘化钾试纸;③淀粉;④白糖;⑤食醋;⑥白酒。进行实验时,必须选用的物质有____________。
(3)某工厂废切削液中含有2%~5%的NaNO2,直接排放会造成污染,下列试剂中_____(填序号)能使NaNO2转化为不引起二次污染的N2反应的化学方程式为________________________ (并标出电子转移的数目和方向)。
①NaCl ②NH4Cl ③H2O2 ④浓H2SO4
(4)下列离子在溶液中一定能大量共存的是________。
A.NH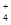 Cl- OH- CO
Cl- OH- CO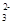 B.Fe2+ NO3- Cl- H+
B.Fe2+ NO3- Cl- H+
C.CH3COO- NH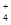 H+ Cl- D.CH3COO- Na+ Cl- SO
H+ Cl- D.CH3COO- Na+ Cl- SO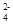
Ⅱ.实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应式为
4CuI+Hg===Cu2HgI4+2Cu。
(1)上述反应产物Cu2HgI4中,Cu元素是________价。
(2) CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式:
 Cu2++
Cu2++ I-===
I-=== CuI+
CuI+ I
I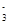
查看答案和解析>>
科目:高中化学 来源:2010年河北省高三下学期第二次考试(理综)化学部分 题型:实验题
(16分)某班学生在老师指导下探究氮的化合物的某些性质。
(1)同学甲在实验室利用下列装置(后面有图)制取氨气和氧气的混合气体,并完成氨的催化氧化。
A中加入浓氨水,D中加入碱石灰,E内放置催化剂(铂石棉),请回答:
①仪器B的名称:__________。B内只需加入一种固体试剂,该试剂的名称为_________,B中能产生氨气和氧气混合气体的原因(结合化学方程式回答)_ __。
②按气流方向连接各仪器 (填接口字母)

(2)同学乙拟用甲同学得到的混合气体X(NO及过量的NH3),验证NO能被氨气还原并测算其转化率(忽略装置内空气的影响)。装置如下:

①装置C的作用可能是 ____________。
②若进入装置A的NO共268.8mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下190.4 mL N2,则NO的转化率为 。
(3)N2O3是一种新型硝化剂。一定温度下,在恒容密闭容器中N2O3可发生下列反应:2N2O3+O2 4NO2(g);△H>0,下表为反应在某温度下的部分实验数据:
4NO2(g);△H>0,下表为反应在某温度下的部分实验数据:
|
t/s |
0 |
500 |
1000 |
|
c(N2O3)/mol·L-1 |
5.00 |
3.52 |
2.48 |
计算在t=500s时,NO2的反应速率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com