
化学是以实验为基础的学科,下列有关实验的描述正确的是
A.向两支分别装有碳酸钠和碳酸氢钠固体的试管中各加几滴水,前者温度降低,后者温度升高
B.向100 mL容量瓶中加入4.0 g NaOH固体,然后加水到刻度线,配制1.0 mol/L的NaOH溶液
C.向酸性重铬酸钾溶液中加NaOH,溶液颜色由橙色慢慢变为黄色
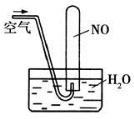
D.如图所示,随着空气的通入,试管内液面会慢慢上升至充满整支试管,而后液面又下降
 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:填空题
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);D原子的基态电子排布式为___________________________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC的空间构型为________(用文字描述)。
 (3)1 mol AB-中含有的π键个数为________。
(3)1 mol AB-中含有的π键个数为________。
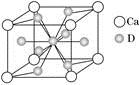
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是________。
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:简答题
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,平且A—和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。
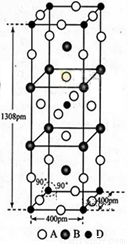
①该化合物的化学式为_________________;D的配位数为___________;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_________;该化合物中存在一个复杂离子,该离子的化学式为________,配位体是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN-、 SO42-
B.c(H+)/c(OH-)=10-10的溶液:K+、Ba2+、NO3- 、Cl-
C.pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42-
D.c(ClO-)=1.0 mol·L-1的溶液:Na+、SO32-、S2-、 SO42-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:选择题
已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12。在只含有KCl、K2CrO4的混合溶液中滴加0.001 mol·L-1的AgNO3溶液,当AgCl与Ag2CrO4共存时,测得溶液中CrO42-的浓度是5.000×10-3 mol·L-1,此时溶液中Cl-的物质的量浓度是
A.1.36×10-5 mol·L-1
B.8.90×10-6 mol·L-1
C.4.45×10-2 mol·L-1
D.1×10-5 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:填空题
【化学与技术】
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理,回答下列问题:
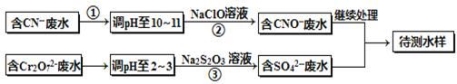
(1)上述处理废水流程中主要使用的方法是______。
(2)②中反应后无气体放出,该反应的离子方程式为 。
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为 。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液, 蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因 。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeII[FeCr]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是_______。
A.x =0.5 ,a =8 B.x =0.5, a = 10
C.x = 1.5 ,a =8 D.x = 1.5 ,a = 10
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol·L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol·L-1 NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液。则所取样品中铝的物质的量为
A.0.005 mol
B.0.010 mol
C.0.020 mol
D.0.030 mol
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:选择题
高温下焙烧CuFeS2的反应之一为2CuFeS2+7O2=CuSO4+CuO+Fe2O3+3SO2,下列关于该反应的叙述正确的是
A.CuFeS2中硫的化合价为-1
B.CuFeS2发生还原反应
C.1 mol CuFeS2完全反应转移13 mol电子
D.CuSO4和SO2既是氧化产物,又是还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com