

| ||
| ||
 ;H2O+与H2S发生氧化还原反应生成S、水与H+,反应离子方程式为:2H2O++H2S=S↓+2H2O+2H+,
;H2O+与H2S发生氧化还原反应生成S、水与H+,反应离子方程式为:2H2O++H2S=S↓+2H2O+2H+, ;2H2O++H2S=S↓+2H2O+2H+;
;2H2O++H2S=S↓+2H2O+2H+;

科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | M | N | P |
| 原子半径/nm | 0.186 | 0.143 | 0.075 | 0.074 | 0.152 | 0.099 |
| 元素的主要化合价 | +1 | +3 | +5、-3 | -2 | +1 | +7、-1 |
| A、X、N元素的金属性:X>N |
| B、Y、M元素形成的离子化合物是工业冶炼Y的原料 |
| C、X单质在M单质中燃烧生成的化合物39g中共含有0.5NA个阴离子 |
| D、标准状况下1L 1mol?L-1的YP3溶液中含有NA个Y3+离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、推进以防治PM2.5为重点的大气污染防治工作 |
| B、积极推广风能、太阳能、氢能等新型能源的使用 |
| C、将生活垃圾、废品分类,实现资源再循环 |
| D、将高能耗、高污染的企业迁至偏僻的农村地区,提高当地居民收入 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“红外眼睛”对热非常敏 |
| B、“红外眼睛”的热目标是敌机发动机或尾部喷口高温区 |
| C、“红外眼睛”的电阻值随温度明显变化 |
| D、“红外眼睛”的工作原理与人眼相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ①B2H4 |
| ②H2O2/OH |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
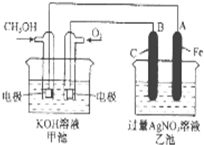 右图是一个化学过程的示意图.已知甲池的总反应式为:
右图是一个化学过程的示意图.已知甲池的总反应式为:查看答案和解析>>
科目:高中化学 来源: 题型:
| 乙醇 |


查看答案和解析>>
科目:高中化学 来源: 题型:
 已知甲、乙、丙、丁4种物质均含有常见金属元素A,其中甲为红棕色粉末,它们之间有如图所示的转化关系(转化过程中部分产物未标出)
已知甲、乙、丙、丁4种物质均含有常见金属元素A,其中甲为红棕色粉末,它们之间有如图所示的转化关系(转化过程中部分产物未标出)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com