
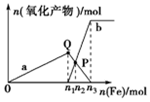
 含1mol 溶质HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断正确的是( )
含1mol 溶质HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断正确的是( )| A. | 曲线a表示Fe2+,曲线b表示Fe3+ | |
| B. | P点时总反应的离子方程式可表示为5Fe+16H++4NO3-═3Fe2++2Fe3++4NO↑+8H2O | |
| C. | n2=0.3 | |
| D. | n3:n1=3:1 |
分析 向稀硝酸中加入铁粉时,发生两个过程,开始先生成Fe(NO3)3,反应方程式为:Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O,当铁过量时,过量的铁再与 Fe(NO3)3反应生成 Fe(NO3)2,2Fe(NO3)3+Fe=3 Fe(NO3)2,P点为 Fe(NO3)3 与 Fe(NO3)2物质的量相等的点,参加反应的硝酸为1mol,利用方程式计算出 Fe(NO3)3为0.25mol,可求n1,由此分析解答.
解答 解:A、向稀硝酸中加入铁粉时,发生两个过程,开始先生成Fe(NO3)3,反应方程式为:Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O,根据硝酸的物质的量为4mol利用方程式可计算出生成的 Fe(NO3)3为1mol,所以参加反应的硝酸为1mol即n1=0.25,a表示Fe(NO3)3,故A错误;
B、Fe(NO3)3 与过量的铁继续反应生成 Fe(NO3)2,反应方程式为:2Fe(NO3)3+Fe=3 Fe(NO3)2,P点为 Fe(NO3)3 与 Fe(NO3)2物质的量相等的点,随后是Fe(NO3)3 与过量的铁继续反应生成 Fe(NO3)2,反应方程式为:2Fe(NO3)3+Fe=3 Fe(NO3)2,P点为 Fe(NO3)3 与 Fe(NO3)2物质的量相等的点,故B错误;
C、根据铁原子守恒,n(Fe)=n(Fe(NO3)2)+n(Fe(NO3)),所以 n(Fe)=0.3mol,即n2=0.3mol,故C正确;
D、向稀硝酸中加入铁粉时,发生两个过程,开始先生成Fe(NO3)3,反应方程式为:Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O,根据硝酸的物质的量为1mol利用方程式可计算出生成的 Fe(NO3)3为0.25mol,所以参加反应的铁为0.25mol即n1=0.25,将0.25mol的 Fe(NO3)3转化为 Fe(NO3)2需要的金属铁是0.125mol,所以n3=0.25mol+0.125mol=0.375mol,n3:n1=3:2,故D错误.
故选C.
点评 本题考查了铁与稀硝酸的反应,要注意铁和硝酸谁多谁少,以及加入的顺序,难度较大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 通入了1 molCl2的新制氯水中,HClO、Cl-、C1O-粒子数之和为2NA | |
| B. | 标准状况下,22.4L NH3和HCl的混合气体中含有的分子总数为NA | |
| C. | 常温下,pH=2的H2SO4溶液中含有的H+数目为0.02NA | |
| D. | 高温下,0.3mol Fe与足量的水蒸气完全反应失去的电子数为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 适当升高温度能促进FeCl3水解 | |
| B. | 加水稀释能促进其水解,并提高Fe(OH)3的浓度 | |
| C. | 加少量浓盐酸能促进FeCl3水解 | |
| D. | 保存氯化铁溶液时应加入少量铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2H218O═4NaOH+18O2↑ | |
| B. | K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O | |
| C. | NH4Cl+2H2O?NH3•2H2O+HCl | |
| D. | CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖、蔗糖均可发生银镜反应 | |
| B. | 硫酸铵和乙酸铅均能使蛋白质发生变性 | |
| C. | 乙炔和乙醛均可作为合成聚合物的单体 | |
| D. | 淀粉和油脂都是能够发生水解反应的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 | |
| B. | 在食品袋中放人盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| C. | 用含橙色酸性重铬酸钾的仪器检验酒驾,利用了乙醇的挥发性和还原性 | |
| D. | 光太阳能电池先将光能转化为化学能,然后再将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解和蛋白质水解都是由高分子化合物生成小分子物质的过程 | |
| B. | 乙烯分别使溴水和酸性KMnO4溶液褪色,反应原理相同 | |
| C. | C6H14有5种同分异构体 | |
| D. | CH4和Cl2按体积比1:3混合可制得纯净的CHCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属间发生置换反应 | |
| B. | 金属元素的最高价氧化物对应水化物的碱性强弱 | |
| C. | 1mol金属单质在反应中失去电子的多少 | |
| D. | 金属元素的单质与水或酸反应置换出氢气的难易 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com