
| A. | c(HCl)>c(CH3COOH) | |
| B. | c(Cl-)=c(CH3COO-) | |
| C. | 等体积的盐酸和醋酸溶液分别与足量的Zn完全反应,盐酸产生的H2多 | |
| D. | 用同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的NaOH溶液体积多 |
分析 A.醋酸为弱酸,在溶液中只能部分电离出氢离子,据此判断二者浓度大小;
B.根据两溶液中的电荷守恒判断;
C.醋酸浓度较大,则与足量锌反应时醋酸放出的氢气多;
D.醋酸的浓度大于盐酸,则醋酸溶液消耗的氢氧化钠溶液体积大.
解答 解:A.醋酸为弱电解质,在溶液中部分电离,若pH相等时,醋酸浓度较大,即c(HCl)<c(CH3COOH),故A错误;
B.溶液的pH相等,则两溶液中的氢离子、氢氧根离子浓度相等,根据电荷守恒可知c(Cl-)=c(CH3COO-),故B正确;
C.等体积的盐酸和醋酸溶液分别与足量的Zn完全反应,由于醋酸的浓度较大,则醋酸产生的H2多,故C错误;
D.同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,由于醋酸的浓度大于盐酸,则醋酸消耗的NaOH溶液体积多,故D错误;
故选B.
点评 本题考查了弱电解质的电离及其影响,题目难度中等,明确弱电解质的电离特点为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
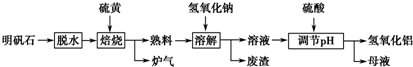
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
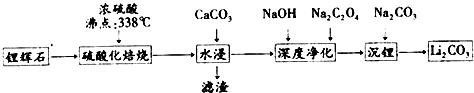
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某试样焰色反应呈黄色,则试样中含有K+ | |
| B. | 广泛pH试纸测得某碱性溶液的pH为12.5 | |
| C. | 容量瓶不能用作溶解物质的容器 | |
| D. | 粗盐的提纯试验中,滤液在坩埚中加热蒸发结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硬脂酸甘油酯属于高级脂肪酸甘油酯,是高分子化合物 | |
| B. | 含淀粉或纤维素的物质可以制造酒精 | |
| C. | 鸡蛋清的溶液中加入硫酸铜溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃C5H12的同分异构体中,主链最短的一种系统命名为2,2-甲基丙烷 | |
| B. | 石油分馏和裂化的目的都是为了将长链烃转化为短链烃 | |
| C. | 蛋白质溶液中加入硫酸铜溶液,导致蛋白质变性,失去生理活性 | |
| D. | 高分子化合物(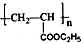 )的单体是CH2=CH2和C2H5COOH )的单体是CH2=CH2和C2H5COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol FeCl3 水解生成的Fe(OH)3胶粒数为lNA | |
| B. | 4.6g有机物C2H6O的分子结构中含有的C一H键数目一定为0.5NA | |
| C. | 标准状况下,11.2 L CO2 与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 1 mol/L AlCl3溶液中含有3NA个Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8NA | |
| B. | 标准状况下,11.2 L 二氯甲烷中含有的分子数目为0.5NA | |
| C. | 常温常压下,28 g乙烯与丙烯的混合气体含有的碳原子数目无法计算 | |
| D. | 0.1 mol•L-1MgCl2溶液中含有的Mg2+数目小于0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com