
分析 (1)元素原子电子层数等于周期序数,最外层电子等于主族元素族序数;
(2)依据同主族元素性质相似性结合钠与水反应产物及性质解答;
(3)依据同主族元素从上到下金属性依次增强递变规律解答.
解答 解:(1)已知铯位于元素周期表中第六周期第IA族,所以核外有6个电子层,最外层有1个电子,各层容纳电子数为:2 8 18 18 8 1,质子数等于电子数为55,原子序数为55;
故答案为:6;1;55;
(2)铯与钠都是第一主族元素,性质相似,钠与水反应生成氢氧化钠和氢气,则铯与水反应生成氢氧化铯和氢气,方程式2Cs+2H2O=2CsOH+H2↑,氢氧化铯为强碱,溶液显碱性,石蕊变蓝色;
故答案为:无;蓝;2Cs+2H2O=2CsOH+H2↑;
(3)同主族元素从上到下金属性依次增强递,铯位于钠的下方,二者都是同主族元素,所以铯的金属性强于钠,单质的还原性强于钠;
故答案为:强.
点评 本题考查了铯的结构及性质,熟悉同主族元素原子结构特点及性质相似性和递变性是解题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
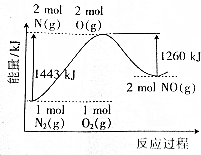
| A. | 氮气和氧气的反应是氧化还原反应,也是放热反应 | |
| B. | 1molNO分子被拆成原子要放出630kJ能量 | |
| C. | 1molN2(g)和1molO2(g)完全反应生成2molNO(g)时吸收183kJ能量 | |
| D. | 在酒精灯加热条件下,N2和O2能发生化合反应生成NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +4→+3 | B. | +2→+3 | C. | 0→+2 | D. | -4→-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷$\stackrel{AgNO_{3}溶液}{→}$浅黄↓ | |
| B. | 溴乙烷$→_{HNO_{3}}^{AgNO_{3}}$浅黄↓ | |
| C. | 溴乙烷$→_{△}^{NaOH和水}$$→_{AgNO_{3}溶液}^{HNO_{3}}$浅黄↓ | |
| D. | 溴乙烷$→_{△}^{NaOH和乙醇}$$\stackrel{AgNO_{3}溶液}{→}$浅黄↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下有下列四种溶液:
常温下有下列四种溶液:| 序号 | ① | ② | ③ | ④ |
| 溶液 | pH=4的NH4Cl溶液 | pH=4的盐酸 | 0.1mol•L-1的醋酸溶液 | 0.1mol•L-1的NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com