
据报道,我国拥有完全自主产权的氢氧燃料电池车将在奥运会期间为运动员提供服务.某种氢氧燃料电池的电解液为KOH溶液.下列有关电池的叙述不正确的是()
A. 正极反应式为:O2+2H2O+4e﹣═4OH﹣
B. 工作一段时间后,电解液中的KOH的物质的量不变
C. 该燃料电池的总反应方程式为:2H2+O2═2H2O
D. 用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mol电子转移
考点: 电解原理;化学电源新型电池.
专题: 电化学专题.
分析: KOH溶液为电解液的氢氧燃料电池中,通入氢气的一极为电池的负极,发生氧化反应,电极反应式为H2﹣2e﹣+2OH﹣=2H2O,通入氧气的一极为电池的正极,发生还原反应,电极反应式为O2+2H2O+4e﹣=4OH﹣,反应的总方程式为2H2+O2=2H2O,结合电极反应解答该题.
解答: 解:A.通入氢气的一极为电池的负极,发生氧化反应,电极反应式为2H2﹣4e﹣+4OH﹣=4H2O,通入氧气的一极为电池的正极,发生还原反应,电极反应式为O2+2H2O+4e﹣=4OH﹣,故A正确;
B.工作一段时间后,电池中生成水,溶液体积增大,电解液中KOH的物质的量浓度减小,依据电极反应可知,物质的量不变,故B正确;
C.正极反应为O2+2H2O+4e﹣=4OH﹣,负极反应为H2﹣2e﹣+2OH﹣=2H2O,则总反应式为:2H2+O2=2H2O,故C正确;
D.n(Cl2)=0.01mol,根据化合价可知转移电子0.2mol,故D错误;
故选D.
点评: 本题考查原电池的工作原理,题目难度中等,解答该题的关键是把握原理,能正确书写电极反应式.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
Cr2O72﹣和CN﹣是工业废水中常见的污染物.若利用下列流程可对分别含两种离子的废水进行综合处理:
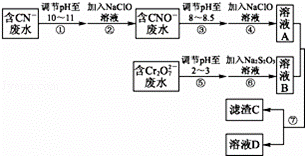
已知:Cr3+也有一定毒性,Cr3+在pH=6.0时开始沉淀,pH=8.0时沉淀完全.
回答下列问题:
(1)已知步骤②中无气体生成,写出反应的离子方程式: ,
步骤④中NaClO可将CNO﹣处理为完全无害的溶液,该过程中有两种无毒的不支持燃烧的气体产生,写出这两种气体的化学式: .
(2)步骤⑥的反应为S2O32﹣+Cr2O72﹣+H+﹣→SO42﹣+Cr3++H2O(未配平),则每处理1mol Cr2O72﹣转移6mol电子.
(3)滤渣C的化学式为Cr(OH)3,溶液A和溶液B混合可使废水中的Cr3+沉淀的原因是 .
(4)步骤⑦的操作名称为 ,若该操作在实验室中进行,则所需的玻璃仪器为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 单质铯的熔点比单质锂的高 |
|
| B. | 胶体的胶粒不能通过滤纸 |
|
| C. | 元素N的氢化物的沸点比元素P的氢化物的沸点低 |
|
| D. | 用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在某容积可变的密闭容器中,有下列的可逆反应:A(g)+B(g)⇌xC(g),有图1(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线.若试判断对图2的说法中正确的是( )
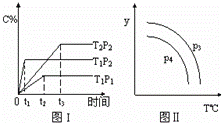
|
| A. | P3>P4,y轴表示C的体积分数 |
|
| B. | P3<P4,y轴表示B的质量分数 |
|
| C. | P3<P4,y轴表示混合气体的密度 |
|
| D. | P3>P4,y轴表示混合气体的平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z在周期表中的位置关系如图所示,则下列叙述中正确的是()
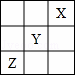
A. Z一定是活泼的金属元素
B. Y的最高价氧化物的水化物是一种强酸
C. Y的氢化物稳定性大于Z的氢化物稳定性
D. X、Y、Z各元素的最高正价与最低负价的绝对值之和均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快.由此判断,影响化学反应速率的因素有 和 .
(2)元素周期表共有7周期,16族;同一周期元素的原子 相同.
(3)在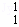 H、
H、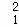 H、
H、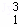 H、
H、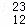 Mg、
Mg、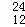 Mg和
Mg和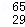 Cu中共有 种元素, 种原子.
Cu中共有 种元素, 种原子.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是()
A. 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B. 氢氧化钡与稀硫酸混合:SO42﹣+H++OH﹣+Ba2+=H2O+BaSO4↓
C. 用稀硫酸洗去铁锈:Fe2O3+6H+=2 Fe3++3H2O
D. 石灰乳与Na2CO3溶液混合:Ca2++CO32﹣=CaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
把VL含有MgSO4和K2SO4的混合溶液分成两份,一份加入a mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡;另一份加入含b mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁.则原混合溶液中钾离子的浓度为()mol/L.
A. 2b﹣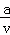 B. 2a﹣
B. 2a﹣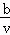 C.
C. 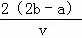 D.
D. 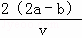
查看答案和解析>>
科目:高中化学 来源: 题型:
电浮选凝聚法处理酸性污水的工作原理如图所示.下列说法不正确的是()
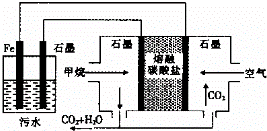
A. 铁电极的电极反应式为:Fe﹣2e﹣═Fe2+
B. 通人空气的石墨电极的电极反应式为O2+2CO2+4e﹣═2CO32﹣
C. 若左池石墨电极产生44.8L(标准状况)气体,则消耗氧气0.5mol
D. 为增强污水的导电能力,可向污水中加入适量工业用食盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com