
【题目】下图装置中,b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答:

(1)c极的电极反应式为________ 。
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,电解进行一段时间后,你能观察到的
现象是:___________,电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应式为_____________。
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了____moL气体,
此时若b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为___________。
此时A池中溶液氢离子的浓度为_________mol/L。
【答案】 2I—-2e-=I2 C极附近溶液变为蓝色 4OH——4e-=2H2O+O2 0.001 108 g·mol-1 0.02
【解析】由电解原理可得:金属M沉积于b极,说明b是阴极,则a是阳极,c是阳极,d是阴极,(1)因a是阳极,溶液中的阴离子放电,根据离子的放电顺序,可知c极的电极反应式为2I—-2e—=I2;(2)在B烧杯中,c是阳极,溶液中的阴离子放电,即2I—-2e—=I2,I2遇到淀粉能使淀粉变蓝,I-放电完毕后,接着是OH-放电,c极上的试管中收集到的气体为氧气,此时c极上的电极反应式为:4OH--4e-=2H2O+O2↑; (3)d极是溶液中氢离子放电:
2H+ + 2e- = H2↑
0.004mol ![]()
a极上氢氧根离子放电:
4OH--4e-=2H2O+O2↑
0.004mol 0.001mol
即氧气的物质的量为0.001mol
b电极上沉积金属M:M+ + e- = M
0.004mol 0.004mol
则金属的摩尔质量M=![]() =
= ![]() =108g/mol;
=108g/mol;
根据a极上氢氧根离子放电:4OH--4e-=2H2O+O2↑有0.004mol OH-消耗,则溶液中H+的物质的量为0.004mol,浓度为![]() =0.02mol/L。
=0.02mol/L。


科目:高中化学 来源: 题型:
【题目】在一定温度下的固定容积的密闭容器中,发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0,能说明该反应已达平衡状态的是( )
CH3OH(g)+H2O(g) △H<0,能说明该反应已达平衡状态的是( )
A. 反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
B. 混合气体的密度不随时间的变化而变化
C. 单位时间内每消耗1.2mol H2,同时生成0.4mol H2O
D. CO2的体积分数在混合气体中保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O] 俗称莫尔盐,可溶于水,在100℃~110℃时分解。在定量分析中常用作标定重铬酸钾、高锰酸钾等溶液的标准物质,还用于冶金、电镀等。
Ⅰ.化学课外活动小组研究莫尔盐晶体强热时的分解产物。
(1)甲组同学按照如图所示的装置进行研究,装置C中可观察到的现象是__________,由此可知分解产物中有____________。
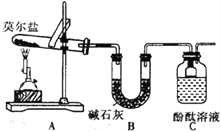
(2)乙组同学认为莫尔盐晶体分解的产物中还含有SO3(g)、SO2(g)及N2。为进行验证,选用甲组实验中的装置A和下图所示的部分装置进行实验。
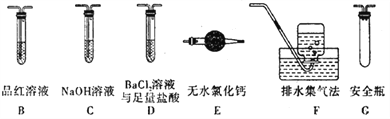
①乙组同学的实验中,装置依次连接的合理顺序为A、____________。
②含有SO3的实验现象是______________;
Ⅱ.为测硫酸亚铁铵纯度,称取m g莫尔盐样品,配成500mL溶液。甲、乙、丙三位同学设计了如下三个实验方案,请回答:
甲方案:取25.00mL硫酸亚铁铵溶液用0.1000mol·L-1的酸性KMnO4溶液分三次进行滴定。
乙方案:取25.00 mL硫酸亚铁铵溶液进行如下实验。
![]()
丙方案:(通过![]() 测定)实验设计图如下所示。取25.00mL硫酸亚铁铵溶液进行该实验。
测定)实验设计图如下所示。取25.00mL硫酸亚铁铵溶液进行该实验。
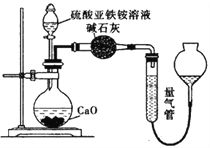
(1)甲方案中的离子方程式为___________,若实验操作都正确,但其测定结果总是小于乙方案,可能原因为___________。
(2)乙方案中沉淀是否洗涤干净的检验方法是________________。
(3)丙方案中量气管中最佳试剂是______________。
a.水 b.饱和NaHCO3溶液 c.CCl4
(4)若测得NH3(已折算为标准状况下)为V L,则硫酸亚铁铵纯度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E代表单质或化合物,它们之间的相互转换关系如图所示.A为地壳中含量仅次于氧的非金属元素的单质. 
请填空:
(1)形成单质A的原子的结构示意图为 , 它的最高化合价为 .
(2)B的化学式(分子式)为 , B和碳反应生成A和E的化学方程式是 .
(3)C的化学式(分子式)为 , D的化学式(分子式)为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产和生活密切相关,下列说法正确的是( )
A.铁制品表面镀锡不能增强铁制品的抗腐蚀性
B.被Cu2+污染的水体可以用难溶的FeS进行治理
C.施用化肥时,将草木灰与氯化铵混合使用可增加肥效
D.世界能源大会将核能作为碳能源重要替代品,核电站能够把化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A. Na+、Cu2+、Cl-、SO42- B. Na+、Ca2+、CO32-、NO3-
C. Na+、H+、Cl-、CO32- D. K+、H+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g 铜镁合金完全溶解于50mL 密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种叠氮桥基配位化合物C的合成方法如下:下列叙述正确的是

A. Br价电子排布式为1s22s22p63s23p63d104s24p5 B. NaN3中N3-立体构型为V形
C. 物质C中氮原子杂化形式为sp、sp2、sp3 D. CH3OH是手性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列电解质溶液:①Na 2CO3 ②NaHCO3 ③苯酚钠(不与碱反应) ④CH3COONH4 ⑤NH4HCO3
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号):
(2)已知:酸性H2CO3>苯酚>HCO3﹣ . 常温下,物质的量浓度相同的①、②、③溶液pH大小顺序为(填写序号):
(3)写出⑤与足量NaOH溶液混合加热反应的离子方程式
(4)已知常温下CH3COONH4 溶液呈中性,根据这一事实推测⑤溶液的pH7(填>、=或<),理由是: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com