
用惰性电极进行电解,下列说法正确的是( )
|
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液pH不变 |
|
| B. | 电解稀氢氧化钠溶液,要消耗OH﹣,故溶液pH减小 |
|
| C. | 电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2 |
|
| D. | 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1 |
| 原电池和电解池的工作原理.. | |
| 专题: | 电化学专题. |
| 分析: | A、根据溶液中氢离子的浓度是否变化判断; B、根据溶液中氢离子的浓度是否变化判断; C、根据得失电子守恒判断阴极上和阳极上析出产物的物质的量之比; D、根据离子的放电顺序判断在阴极上和阳极上析出产物,再根据得失电子守恒判断阴极上和阳极上析出产物的物质的量之比; |
| 解答: | 解:A、电解稀硫酸时,实质上是电解水,溶剂的质量减少,溶质的质量不变,所以溶液的浓度增大,氢离子的浓度增大,溶液的PH值变小,故A错误. B、电解稀氢氧化钠溶液时,实质上是电解水,溶剂的质量减少,溶质的质量不变,所以溶液的浓度增大,氢氧根离子的浓度增大,溶液的PH值变大,故B错误. C、电解硫酸钠溶液时,实质上是电解水,阴极上氢离子的电子生成氢气,阳极上氢氧根离子失电子生成氧气,根据得失电子守恒,所以在阴极上和阳极上析出产物的物质的量之比为2:1,故C错误. D、电解氯化铜溶液时,阴极上铜离子得电子生成铜,阳极上氯离子失电子生成氯气,根据得失电子守恒,在阴极上和阳极上析出产物的物质的量之比为1:1,故D正确. 故选D. |
| 点评: | 本题以电解原理为载体考查了电解时溶液中离子的放电顺序及溶液PH是否变化,电解类型有:电解水型,如电解稀硫酸溶液;电解电解质型,如电解氯化铜溶液;电解电解质和水型,如电解氯化钠溶液. |


科目:高中化学 来源: 题型:
下图是实验室制备SO2并验证SO2某些性质的装置图。
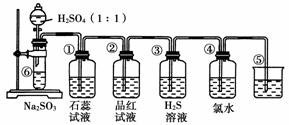
试回答:
(1)⑥中发生反应的化学方程式为__________________________________ ________________________________________________________。
(2)①中的实验现象为______________,此实验证明SO2是________气体。
(3)②中的品红溶液________,证明SO2有________性。
(4)③中的实验现象是__________,证明SO2有________性。
(5)④中的实验现象是__________,证明SO2有________性。
(6)⑤的作用是__________________________,化学方程式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A和甲是来自石油和煤的两种基本化工原料。A是气态烃,甲是液态烃。B和D是生活中两种常见的有机物,F是高分子化合物。相互转化关系如图所示:
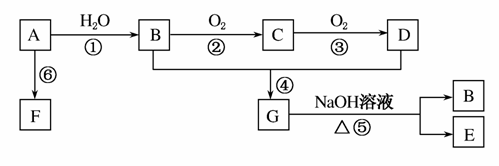
(1)A分子的电子式为________;C的分子式为________;D中官能团名称为________。
(2)在反应①~⑥中,属于加成反应的是________,属于取代反应的是________(填序号)。
(3)B和D反应进行比较缓慢,提高该反应速率的方法主要有________________________________________________________________________;
用于鉴别B、D和甲的一种试剂是______________________。
(4)写出下列反应的化学方程式:
②B—→C:__________________________________________;
④B+D—→G:_______________________________________;
⑤G—→B+E:_______________________________________;
⑥A—→F:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列物质的化学性质,判断其应用错误的是( )
|
| A. | 酒精能使蛋白质变性,可用于杀菌消毒 |
|
| B. | CaO能与SO2反应,可作工业废气的脱硫剂 |
|
| C. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
|
| D. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将NaClO3和Na2SO3按物质的量比2:1加入烧瓶中,再滴入少量H2SO4溶液并用水溶解、加热,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应.则X为( )
|
| A. | ClO2 | B. | Cl2O | C. | Cl2 | D. | Cl2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
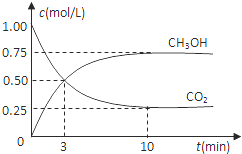
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L•min).
②该反应的平衡常数表达式为 k= .
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH﹣﹣4e﹣=O2↑+2H2O,则阴极反应式为: .
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染.请你判断是否可行并说出理由: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于卤族元素和碱金属性质的叙述中,不正确的是 ( )
A. 卤素单质的熔点和沸点随核电荷数的增加逐渐升高
B. 碱金属单质与水反应生成碱和氢气
C. 碱金属单质在空气中燃烧都可生成过氧化物
D. 卤素的氢化物的还原性性随核电荷数的增加逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.检测乙醇中是否含有水可加入少量的无水硫酸铜,如变蓝则含水
B.除去乙醇中的微量水可加入金属钠,使其完全反应
C.获得无水乙醇的方法通常采用先用浓H2SO4吸水,然后再加热蒸馏的方法
D.获得无水乙醇的方法通常采用先用生石灰吸水,然后再加热蒸馏的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com