
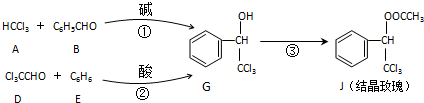
| KOH |
 +
+
| 酸 |
 +H2O,则经反应路线②得到一种副产物,其核磁共振氢谱有4组峰,各组吸收峰的面积之比为
+H2O,则经反应路线②得到一种副产物,其核磁共振氢谱有4组峰,各组吸收峰的面积之比为 和乙酸发生酯化反应生成
和乙酸发生酯化反应生成 ,反应的化学方程式为:
,反应的化学方程式为: +CH3COOH
+CH3COOH| 浓硫酸 |
| △ |
 +H2O,
+H2O, +CH3COOH
+CH3COOH| 浓硫酸 |
| △ |
 +H2O;
+H2O; +
+
| 酸 |
 +H2O可知,
+H2O可知, 能够与G
能够与G 反应生成
反应生成 ,该有机物分子中含有4种位置不同的H,个数之比为1:2:4:4(苯环对称),则各组吸收峰的面积之比为1:2:4:4,
,该有机物分子中含有4种位置不同的H,个数之比为1:2:4:4(苯环对称),则各组吸收峰的面积之比为1:2:4:4, 或
或  ,
, 或
或  .
.


科目:高中化学 来源: 题型:
| A、分子式为CH4O和C2H6O的物质不一定互为同系物 |
| B、通过乙烷的取代反应或乙烯的加成反应都可以制取纯净的氯乙烷 |
| C、淀粉.纤维素都属于糖类,它们通式相同,但它们不互为同分异构体 |
| D、某有机化合物仅由C.H.O三种元素组成,其相对分子质量小于150,若已知其中氧的质量分数为50%,则分子中碳原子的个数最多为5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、HCO3-、SO32-、OH- |
| B、Al3+、H+、SiO32-、I- |
| C、Fe2+、K+、NO3-、SO42- |
| D、Fe3+、NH4+、ClO-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
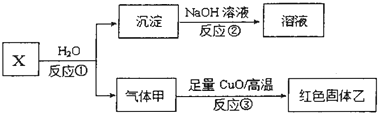
查看答案和解析>>
科目:高中化学 来源: 题型:
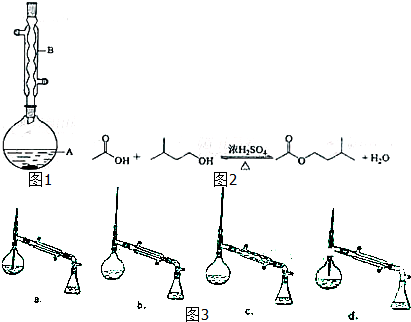
| 相对分子质量 | 密度/(g?cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
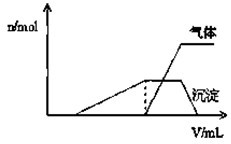 1L某混合溶液,可能含有的离子如下表:
1L某混合溶液,可能含有的离子如下表:| 可能大量含有的阳离子 | H+NH4+Al3+K+ |
| 可能大量含有的阴离子 | Cl-Br-I?ClO?AlO2- |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | ||||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、分子式为C3H6N303 |
| B、分子中既含极性键,又含非极性键 |
| C、属于共价化合物 |
| D、生成该物质的上述反应为中和反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com