
【题目】有一种蓝色的晶体,它的结构特征是Fe2+和Fe3+分别占据立方体互不相邻的顶点,立方体的每个棱上均有一个CN-。
(1)根据晶体结构的特点,推出这种蓝色晶体的化学式(用简单整数表示)_____________。
(2)此化学式带何种电荷________,如用Rn+或Rn-与其结合成电中性粒子,此粒子的化学式为__________________________。
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.根据反应Fe+H2SO4=FeSO4+ H2↑ 回答下列问题。
(1)在此反应中,自反应开始至2分钟末,H2SO4浓度由1mol/L变为0.4mol/L,则H2SO4的反应速率为 。若要使该反应的反应速率加快,下列措施不可行的是 (填字母)
a、改铁片为铁粉 b、改稀H2SO4为98%的浓H2SO4
c、升高温度 d、滴加少量CuSO4溶液
(2)在答题卡的坐标图中,画出此反应过程中体系的能量变化图(进行必要的标注)
(3)根据此反应设计一个原电池,要求画出装置图并进行必要的标注
Ⅱ.某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。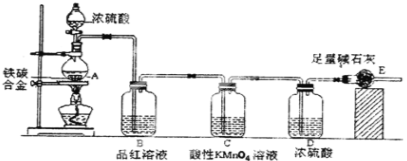
(1)将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,加热,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为____________(写表达式)。
(2)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某种烷烃A在同温同压下蒸气的密度是H2的43倍, 则该烃的分子式 。
(2)某烷烃B含有16个共价键,则该烃的同分异构体有 种。
(3)某烷烃C的结构简式为CH3CH2CH(CH3)2,则该烃的一氯取代物有 种。
(4)某烃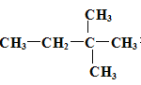 由另一种烃D通过加成反应而制得,则烃D的可能的是 (任写一种可能的结构简式)。
由另一种烃D通过加成反应而制得,则烃D的可能的是 (任写一种可能的结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线.请分析讨论以下问题。
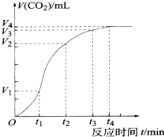
(1)碳酸钙与稀盐酸的反应是放热反应,这是由于反应物的总能量 (填“大于”或“小于”)生成物的总能量。
(2)在0~t1、t1~t2、t2~t3、t3~t4各相同的时间段里,收集到气体最多的是 时间段。反应速率最大的是 时间段,反应速率最小的是 时间段。
(3)t1~t2时间段里影响反应速率的主要外界因素 、t2~t3时间段里影响反应速率的主要外界因素是 (填“温度”或“浓度”或“压强”或“催化剂”)(提醒:多填不得分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环上原有的取代基对新取代导入苯环上的取代基的位置有一定的影响,其规律是(1)苯环上新导入的取代基所占的位置主要决定于原有取代基的性质;(2)可以把原有取代基分成两类:第一类取代基主要使新导入的取代基进入苯环的邻位和对位,如—OH、—CH3(或烃基)、—Cl、—Br、—O—COR等。第二类取代基主要使新导入的取代基进入苯环的间位,如—NO2、—SO3H、—CHO等。请写出下图中②④⑤三步反应的化学方程式。
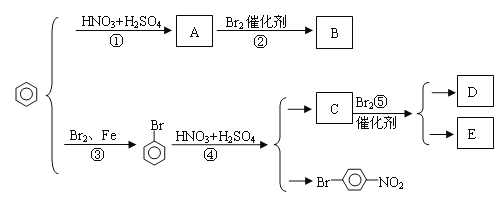
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求对下图中两极进行必要的联接并填空:

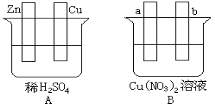
(1)在A图中,使铜片上冒H2气泡。对装置加以联接,则联接后的装置叫 。
电极反应式:锌板: ;铜板: 。
(2)在B图中,a、b两电极均为石墨,对装置加以联接,使a极析出铜,则b析出 。该装置叫 。电极反应式,a极: b极: 。经过一段时间后,停止反应并搅匀溶液,溶液的pH值 (升高、降低、不变),加入一定量的 (填化学式)后,溶液能恢复至与电解前完全一致。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长。
(1)砷的氢化物的化学式为________,其稳定性比磷的氢化物____(填“强或弱”)。已知H3AsO3是两性偏酸性的化合物,它与硫酸反应的化学方程式为 。NaHAsO3溶液呈碱性,该溶液中c(H2AsO3-) C(AsO33-)(填“>”、“<”或“=”)。
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在。
①工业上以雄黄为原料制备砷的过程是:先在空气中煅烧使其转化为砒霜(As2O3),然后用焦炭还原。写出焦炭还原时发生反应的化学方程式: 。砒霜有剧毒,卫生防疫分析中鉴定的方法是:先将试样与锌、硫酸混合在一起反应,将生成的气体导入到热玻璃管中热解,若玻璃管中产生亮黑色的“砷镜”,则说明试样中含有As2O3。写出上述鉴定过程中有关反应的化学方式: 。
②“砷镜”可被漂白精氧化为H3AsO4,反应中还原剂与氧化剂物质的量之比为 。
(3)已知砷酸(H3AsO4)是三元酸,有较强的氧化性。
①常温下砷酸的K1=6×10-3、K2=1×10-7,则NaH2AsO4溶液的pH为____7。(填“>”、“<”、“=”),判断依据为___________________________________________________________________。
②某原电池装置如图所示,电池总反应为AsO43-+2I-+H2O![]() AsO33-+I2+2OH-。
AsO33-+I2+2OH-。
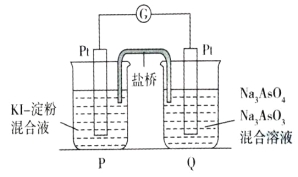
当P池中溶液由无色变成蓝色时,正极上的电极反应式为 。当电流计指针归中后向Q池中加入一定量的NaOH,则电池负极所在的烧杯为 (填“P”或“Q”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米ZnO在催化、医药及橡胶等新材料方面有广阔的应用前景,下面是制备纳米ZnO的相关工艺流程,试回答有关问题:
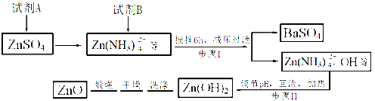
已知:Ksp[Zn(OH)2]=4.5×10-17,且Zn(OH)2具有两性。
(1) 试剂A是_____,试剂B是______,步骤I生成BaSO4的离子方程式是 。
(2)步骤II中,pH应调节至 (填序号)。
a.3~5 b.5 c.8~9 d.12~14
(3)步骤II中“回流”时必须用到下列仪器中的 (填序号)。
a.分液漏斗 b.温度计 c.空气冷凝管 d.球形冷凝管
(4)已知,在实验室中用200 mL 0.25 mol/L ZnSO4溶液与50 mL 8mol/L的试剂A反应,则加入固体试剂B的质量为 (计算结果保留小数点后一位)。
(5)步骤II在加热回流的同时,要蒸出 (填物质名称),该物质可循环使用。
(6)纳米ZnO也可以用以下流程制备(其中反应②生成了两种碳的化合物)。
![]() 书写相关的化学方程式① ,② 。
书写相关的化学方程式① ,② 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖。由青蒿素合成衍生药物蒿甲醚的合成路线如下:下列说法正确的是( )
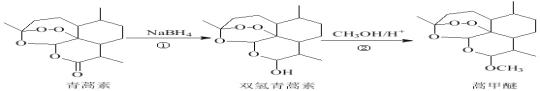
A.①、②反应依次为还原反应、取代反应
B.上述三种有机物的含氧官能团完全相同
C.青蒿素因含酯基具有氧化性和杀菌功能
D.蒿甲醚的化学式为C16H24O5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com