
分析 (1)碳能与二氧化硅反应生成硅单质;
(2)二氧化硅能与氢氟酸反应生成四氟化硅气体;
(3)在常温下,氢氧化钠与玻璃中的二氧化硅缓慢地发生反应,产物使瓶口与瓶塞粘合在一起.
解答 解:(1)工业上制备粗硅是利用碳能与二氧化硅反应生成硅单质,化学反应方程式:SiO2+2C$\frac{\underline{\;\;△\;\;}}{\;}$Si+2CO↑,故答案为:SiO2+2C$\frac{\underline{\;\;△\;\;}}{\;}$Si+2CO↑;
(2)二氧化硅能与氢氟酸反应生成四氟化硅气体,化学反应方程式:SiO2+4HF=SiF4↑+2H2O,故答案为:SiO2+4HF=SiF4↑+2H2O;
(3)玻璃塞中含有二氧化硅,在常温下,氢氧化钠与玻璃中的二氧化硅缓慢地发生反应,产物硅酸钠有粘性,使瓶口与瓶塞粘合在一起,反应的方程式为:SiO2+2NaOH=Na2SiO3+H2O,
故答案为:SiO2+2NaOH=Na2SiO3+H2O;
点评 本题考查化学方程式的书写,题目难度不大,注意把握硅和二氧化硅的性质,注意知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | HO-CH2-CH2-CHO | B. | HOOC-COOH | C. | HO-CH2-CH2-COOH | D. | CH3-COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N、P、O | B. | Li、Be、Mg | C. | C、N、P | D. | O、C、F |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 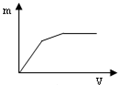 | B. |  | C. | 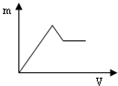 | D. | 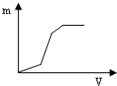 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
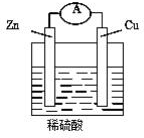 如图,将锌片和铜片用导线连接后加入稀硫酸溶液中,发生原电池反应,下列叙述错误的( )
如图,将锌片和铜片用导线连接后加入稀硫酸溶液中,发生原电池反应,下列叙述错误的( )| A. | 锌是负极,锌片逐渐溶解 | B. | 铜是正极,铜片上有气泡产生 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 电子从锌片经导线流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com