
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1molCl2和足量的铁加热条件下反应,转移电子数一定为3NA
B.常温常压下,8.8g CO2和N2O的混合气体所含电子数为4.4 NA
C.常温下,PH=13的Ba(OH)2 溶液,0.1L,含OH﹣ , 0.02NA
D.1 L 1 mol/L的乙醇水溶液中含有氢原子总数为6NA
【答案】B
【解析】解:A.氯气单质是强氧化剂,能将变价金属氧化到高价态,铁与氯气反应,2Fe+3Cl2 ![]() 2FeCl3 , 铁从0价变为+3价,1mol铁失去3mol电子,电子数为N=n×NA=3×NA=3NA , 但需1.5mol氯气,1molCl2与足量的铁反应,电子转移依据氯气计算,电子转移为2mol,电子数为N=n×NA=2×NA=2NA , 故A错误;
2FeCl3 , 铁从0价变为+3价,1mol铁失去3mol电子,电子数为N=n×NA=3×NA=3NA , 但需1.5mol氯气,1molCl2与足量的铁反应,电子转移依据氯气计算,电子转移为2mol,电子数为N=n×NA=2×NA=2NA , 故A错误;
B.CO2和N2O的摩尔质量相同,都是44g/mol,则8.8gCO2和N2O的物质的量为: ![]() =0.2mol,二者都含有22个电子,则0.2mol混合气体中含有的电子的物质的量为:22×0.2mol=4.4mol,混合气体中所含的电子数为4.4NA , 故B正确;
=0.2mol,二者都含有22个电子,则0.2mol混合气体中含有的电子的物质的量为:22×0.2mol=4.4mol,混合气体中所含的电子数为4.4NA , 故B正确;
C.0.10L pH=13的Ba(OH)2溶液中OH﹣的数目=0.1L×0.1mol/L×NA=0.01NA , 故C错误;
D.1 L 1 mol/L的乙醇水溶液中含乙醇1mol,水中含有氢原子,含有的氢原子总数大于6NA , 故D错误;
故选B.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学与社会、生产和生活密切相关。下列说法错误的是
A.科学家在室温下将气态二氧化碳转化为固体碳材料,该变化是化学变化
B.我国科学家合成了钛掺杂、镧镍锂氧化物正极材料,涉及的金属元素都是过渡元素
C.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机金属材料
D.看电影时,我们可以看到放映机投射的光柱,这是气溶胶发生的丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. 构成原子核的微粒中都含有中子
B. 任何原子或离子的组成中都含有质子
C. 质子数相同的微粒一定属于同一种元素
D. 某元素原子最外层有2个电子,则它一定是ⅡA元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐(如Na2FeO4)已经被广泛应用在水处理方面,以铁基材料为阳极,在高浓度强碱溶液中利用电解的方式可以制备高铁酸盐,装置如图。下列说法不正确的是

A. a为阳极,电极反应式为Fe—6e- +8OH- =FeO42- +4H2O
B. 为防止高铁酸根扩散被还原,则离子交换膜为阳离子交换膜
C. 在电解过程中溶液中的阳离子向a 极移动
D. 铁电极上有少量气体产生原因可能是4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京时间11月1日清晨5时58分07秒,中国“长征二号F”遥八运载火箭在酒泉卫星发射中心载人航天发射场点火发射,火箭的第三级使用的推进剂是液氢和液氧。
已知下面在298K时的热化学方程式:
2H2(g)+O2(g)== 2H2O(l) ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)==CO2(g)+2H2O (l)ΔH=-890.3 kJ·mol-1
C(s)+O2(g)== CO2(g)ΔH=-393.5 kJ·mol-1
根据上面的热化学方程式完成下列问题:
(1)通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是_________。
(2)根据以上反应,则C(s)+2H2(g)== CH4(g)的焓变ΔH=________________。
(3)已知H2O(l)== H2O(g) ΔH=+44.0 kJ·mol-1
试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、及其化合物在生产中有重要应用。
(1)设反应 ① Fe(s) + CO2(g)![]() FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
② Fe(s) + H2O(g)![]() FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
不同温度下,K1、K2的值如下表
T/K | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应 ③ H2(g) + CO2(g)![]() CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ⊿H <0
C2H5OH(g)+3H2O(g) ⊿H <0
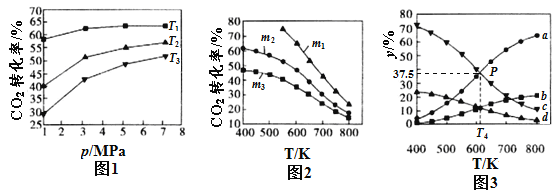
①图l、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=n(H2)/n(CO2),图l中投料比相同,温度从高到低的顺序为________,图2中m1、m2、m3从大到小的顺序为_____________。
②图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质为________(填化学式),T4温度时,该反应的平衡常数Kp=________。(提示:用平衡分压代替平衡浓度来计算,某组分平衡分压=总压×该组分的物质的量分数,结果保留小数点后三位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃(只含有1个双键)与H2加成后的产物是CH3CHCH3CHCH3C(CH3)3,则该烯烃的结构式可能有
A. 1种 B. 2种 C. 3种 D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化学反应方程式的书写及反应类型判断都正确的是
A. CH3CH2OH +Na→CH3CH2ONa + H2↑ 置换反应
B. CH2=CH2+Br2→CH2BrCH2Br 加成反应
C. ![]() 氧化反应
氧化反应
D. C2H6+Cl2 →C2H4Cl2+H2 取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com