
分析 (1)根据pH试纸的使用方法进行分析;
(2)根据溶液稀释后溶液的酸碱性变化与pH值的关系进行解答,溶液呈中性时所测量的数值没有误差;
(3)用水润湿相当于稀释会促进弱电解质的电离.
解答 解:(1)用pH试纸测定的具体测定方法是用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的pH;题中pH试纸用水湿润,将使所得pH值出现误差;
故答案为:错误的;
(2)食盐水溶液显中性,用水稀释后pH不变;酸性溶液稀释后,溶液酸性减弱,pH变大;碱性溶液稀释后,碱性变小,pH值将变小;所以测定的结果不一定有误差,若是中性溶液则不变;
故答案为:不一定,测酸性溶液偏大,测碱性溶液偏小,测中性溶液无影响;
(3)用水润湿相当于稀释,则所测的PH偏小,由于稀释会促进弱电解质的电离,故弱酸的PH误差小,所以在稀释过程中醋酸继续电离出氢离子,使得溶液中氢离子浓度变化比盐酸小,误差小,
故答案为:盐酸;稀释等氢离子浓度的盐酸和醋酸,醋酸存在电离平衡,平衡正向移动.
点评 本题考察了实验基本操作、pH试纸的正确使用方法.若用蒸馏水润湿试纸,则会促进弱电解质的电离,测得pH误差比强电解质小,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
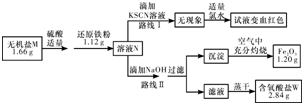
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制0.1mol/L CuSO4溶液100 mL,需称量CuSO4•5H2O 1.6g | |
| B. | 40g NaOH固体溶于1 L水,所得溶液的浓度为1 mol/L | |
| C. | 200mL 0.2mol/L MgCl2溶液中Cl-的个数为0.08NA | |
| D. | 从100mL 1mol/L H2SO4溶液取出10mL溶液,此溶液的浓度为0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+c(RO32-) | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中水的电离程度:①>③>② | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)+c(HA)=c(OH-) | B. | c(OH-)<c(H+)<c(B+)<c(A-) | ||
| C. | c(H+)+c(B+)<c(A-)+c(OH-) | D. | c(A-)=c(B+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和NaHCO3 | B. | Na2CO3和NaCl | C. | Na2CO3和盐酸 | D. | NaHCO3和盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
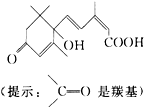
| A. | 含有碳碳双键、羟基、羰基、羧基 | B. | 含有苯环、羟基、羰基、羧基 | ||
| C. | 含有羟基、羰基、羧基、酯基 | D. | 含有碳碳双键、苯环、羟基、羰基 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com