
分析 (1)活泼金属做原电池的负极,原电池中电子从负极经外电路流向电源的正极;
(2)锌比铜活泼,能置换出铜形成原电池加速锌的腐蚀,除杂时注意不能引入新的杂质;
(3)电解酸化的Na2SO4溶液时,根据离子的放电顺序,阴极上首先放电的是H+,电极反应式为:2H++2e-=H2↑,结合Zn~2e-计算电路中通过2mol电子时消耗Zn.
解答 解:(1)Zn-MnO2干电池中,活泼金属锌做原电池的负极,工作时原电池中电子从负极经外电路流向电源的正极,故答案为:Zn,正极;
(2)锌比铜活泼,能置换出铜,反应为Zn+Cu2+=Zn2++Cu,形成原电池加速锌的腐蚀,除杂时注意不能引入新的杂质只有b符合,
故答案为:Zn+Cu2+=Zn2++Cu,形成原电池发生反应;b;
(3)电解酸化的Na2SO4溶液时,根据离子的放电顺序,阴极上首先放电的是H+,电极反应式为:2H++2e-=H2↑,由Zn~2e-可知若电解电路中通过2mol电子,Zn的理论消耗量为1mol×65g/mol=65g,
故答案为:2H++2e-═H2↑;65.
点评 本题考查原电池原理及应用,为高频考点,把握电极、电极反应及转移电子计算为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
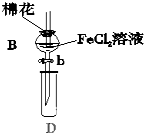 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:| 过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | ②③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
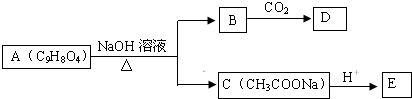
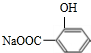 .
.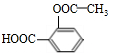 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$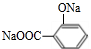 +CH3COONa+2H2O.
+CH3COONa+2H2O.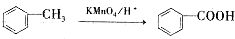 ,且苯酚和乙酸在一定条件下能发生酯化反应.请选用适当物质设计一种合成方法,用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式(其中反应①条件为CH3COOH/浓H2SO4;反应②的条件为KMnO4/H+)
,且苯酚和乙酸在一定条件下能发生酯化反应.请选用适当物质设计一种合成方法,用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式(其中反应①条件为CH3COOH/浓H2SO4;反应②的条件为KMnO4/H+)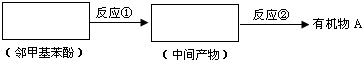
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用燃煤脱硫技术,防治SO2污染 | |
| B. | 实施绿化工程,防治扬尘污染 | |
| C. | 研制开发燃料电池汽车,消除机动车尾气污染 | |
| D. | 加大石油、煤炭的开采速度,增加化石燃料的供应量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b=c | B. | a>b>c | C. | a>c>b | D. | c>a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
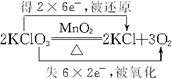 .
.
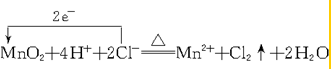 .
.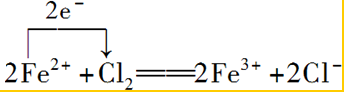 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com