
| A. | 电解过程中,Na+和SO42-的物质的量浓度保持不变 | |
| B. | 电解过程中,溶液颜色呈现红色→紫色→蓝色的变化 | |
| C. | 阴极产生的气体自始至终只有H2 | |
| D. | 第一阶段中阴、阳两极产生的气体混合引燃后,恰好完全反应得到HCl |
分析 根据电解原理:阴极的放电离子:氢离子,阳极离子的放电顺序:氯离子>氢氧根离子,溶液中含有两种溶质NaCl和H2SO4,根据电解原理和离子物质的量,结合电子守恒计算判断放电的离子,来判断电解过程.
解答 解:可以将溶质看成3molNaCl和1molH2SO4,再转化一下思想,可以看成2molHCl,1molNa2SO4,1molNaCl,
由于1molNa2SO4自始至终无法放电,且其溶液pH=7,暂时可以忽略,电极反应为:
阳极:2Cl--2e-=Cl2↑ 2Cl--2e-=Cl2↑ 4OH--4e-=2H2O+O2↑
2 2 1 1
阴极:2H++2e-=H2↑ 2H++2e-=H2↑ 2H++2e-=H2↑
2 2 1 1
则电解过程可先看成电解HCl,再电解NaCl,最后电解水,
即2HCl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑,2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,生成的NaOH为碱性,pH大于7;
A、电解过程中,Na+和SO42-的物质的量不变,但电极过程中溶剂水减少,所以物质的量浓度增大,故A错误;
B、阴极电极过程产物分析,开始蓝色使石蕊变红色,随氢离子放电减小,溶液变为紫色,电解过程中生成的NaOH为碱性,pH大于7石蕊试液颜色又变为蓝色,故B正确;
C、阴极上始终是氢离子得到电子生成氢气,故C正确;
D、第一阶段电解的是氯化氢,的及过程中阴、阳两极产生的气体氢气和氯气,依据电子守恒可知,混合引燃后,恰好完全反应得到HCl,故D正确;
故选A.
点评 本题考查了电解质溶液的混合电解,溶液中离子放电顺序,电子守恒是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蓄电池放电时,每消耗0.1molPbO2,则共生成0.1molPbSO4 | |
| B. | 电解硫酸钠溶液时的阳极反应式为4OH--4e=2H2O+O2↑ | |
| C. | 电解一段时间后若硫酸钠溶液中没有晶体析出则c(Na2SO4)不变 | |
| D. | 蓄电池放电一段时间后其电解液中H2SO4的浓度、密度都变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
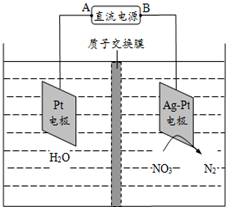
| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 该电解池的阴极反应式为:2NO3-+12H++10e-═N2↑+6H2O | |
| C. | 该电解池的总反应方程式为:2H2O+4NO3-$\frac{\underline{\;电解\;}}{\;}$2N2↑+5O2↑+4OH- | |
| D. | 若电解过程中转移2mol电子,则交换膜右侧电解液的质量减少5.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验Ⅰ:制备少量氧气 | |
| B. | 实验Ⅱ:比较酸性强弱:H2SO4>H2CO3>H2SiO3 | |
| C. | 实验Ⅲ:分离溴的苯溶液 | |
| D. | 实验Ⅳ:观察纯碱的焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干燥的氯气能使湿润的有色布条褪色 | |
| B. | 影响气体体积大小的主要因素是微粒间的距离与微粒的大小 | |
| C. | 汤姆生发现原子中存在电子,并提出了“葡萄干面包式”原子结构模型 | |
| D. | 干冰升华的过程只需克服分子间作用力 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com