
【题目】下列有关说法正确的是( )
①室温下,向AgCl浊液中加入少量NaCl饱和溶液,则c(Ag+)、Ksp(AgCl)均减小
②在![]() =1012溶液中 Na+、I-、NO3-、SO42-不能大量共存
=1012溶液中 Na+、I-、NO3-、SO42-不能大量共存
③在原电池装置中,电子从负极流出,沿导线流入正极,经溶液或盐桥回到负极
④锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
⑤高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
⑥用0.1 mol/LCH3COOH溶液滴定0.1 mol/LNaOH溶液至中性时:c(CH3COO-)+c(CH3COOH)>c(Na+)
⑦100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性
⑧向饱和NaC1溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体
A.②④⑥B.①②⑦C.①④⑤D.③⑤⑧
【答案】A
【解析】
①确定物质的溶度积常数只与温度有关,温度不变,溶度积不变,①错误;
② =1012溶液呈酸性,I-具有还原性,NO3-在酸性溶液中具有强氧化性,H+、I-、NO3-会发生氧化还原反应,不能大量共存,②正确;
=1012溶液呈酸性,I-具有还原性,NO3-在酸性溶液中具有强氧化性,H+、I-、NO3-会发生氧化还原反应,不能大量共存,②正确;
③在原电池装置中,电子从负极流出,沿导线流入正极,溶液中的阳离子在正极得到电子,溶液中的阴离子流向正极,构成闭合回路,③错误;
④锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理得到CaCO3,形成沉淀的转化,然后用稀盐酸除去,④正确;
⑤二氧化硅广泛用于制作光导纤维,不是硅单质,⑤错误;
⑥用0.1 mol/LCH3COOH溶液滴定0.1 mol/LNaOH溶液至中性时:由于c(OH-)=c(H+),且c(CH3COO-)+ c(OH-)=c(Na+)+c(H+),故c(CH3COO-)=c(Na+),则c(CH3COO-)+ c(OH-)=c(Na+)+c(CH3COOH)>c(Na+),⑥正确;
⑦100℃时,水的离子积Kw=l0-12,故pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显碱性,⑦错误;
⑧向饱和NaC1溶液中先通入足量NH3,再通入足量CO2,可析出NaHCO3晶体,⑧错误;
综上分析,正确的是:②④⑥,故合理选项是A。


科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:

回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,一固定体积的密闭容器中发生反应:A(s)+3B(g)![]() 2C(g)+D(g),下列描述中不能说明该反应到达平衡状态的是
2C(g)+D(g),下列描述中不能说明该反应到达平衡状态的是
①混合气体的压强不再变化
②单位时间内生成2a mol C,同时生成3a mol B
③气体密度不再变化
④A的质量不再变化
⑤气体的平均相对分子质量不再变化
⑥2v逆(C)=3v正(B)
A.①③B.②⑤C.①⑥D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.银氨溶液的配制:在洁净的试管中加入2%AgNO3溶液1~2mL,逐滴加入2%稀氨水,边滴边振荡,至沉淀恰好溶解时为止
B.丙醛在催化剂存在下与氢气反应是还原反应,甲醛与新制的Cu(OH)2发生的是氧化反应
C.为了鉴别己烯、甲苯和丙醛,可以使用新制Cu(OH)2悬浊液与溴水
D.乙醇的球棍模型为:![]() ,分子式为CH3CH2OH
,分子式为CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s)![]() C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A.v(A)=2 mol·L-1·min-1B.v(A)=0.2 mol·L-1·s-1
C.v(C)=0.1 mol·L-1·s-1D.v(D)=0.4 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) ![]() 2HI(g) ΔH <0并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g) ΔH <0并达到平衡。HI的体积分数随时间的变化如表格所示:
HI体积分数 | 1min | 2min | 3min | 4min | 5min | 6min | 7min |
条件I | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
条件II | 20% | 33% | 43% | 52% | 57% | 65% | 65% |
下列说法中正确的是
A. 在条件I下,该反应的平衡常数K=10
B. 在条件I下,从开始反应至5min,用H2表示的反应速率为0.10 mol/(L·min)
C. 在条件II下,到达平衡时, I2(g)的转化率为81.25%
D. 与条件I相比,为达到条件II的数据,可能改变的条件是降低压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有几句![]()
①3He、![]() 的化学性质基本相同;
的化学性质基本相同;
②3He、![]() 具有相同的中子数;
具有相同的中子数;
③3He核聚变是化学变化;
④3He液化是物理变化;
⑤3He、![]() 形成的单质中均含有非极性键;
形成的单质中均含有非极性键;
⑥3He、![]() 分别组成的气体单质,在相同条件下密度之比为3:4;
分别组成的气体单质,在相同条件下密度之比为3:4;
⑦由H原子形成![]() 键要吸收热量;
键要吸收热量;
⑧化学变化中的能量变化的大小与反应物的质量多少无关;
⑨在稀溶液中,强酸与强碱发生中和反应生成![]() 时所释放的热量称为中和热;
时所释放的热量称为中和热;
⑩锌锰干电池碳棒是负极,锌片是正极。
A.2B.3C.4D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
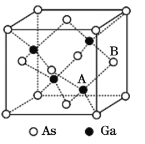
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]____。
(2)根据元素周期律,元素的电负性Ga____(填“大于”或“小于”,下同)As,第一电离能B____Ga;BF3和NH3的分子能够通过配位键相结合的原因是____。
(3)杀虫剂Na3AsO4中阴离子的空间构型为____,As原子采取____杂化。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是____。
(5)原子晶体GaAs的晶胞参数a=x pm,它的晶胞结构如下图所示。该晶胞内部存在的共价键数为____;该晶体的密度为______g/cm3(阿伏加德罗常数的值用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据信息书写相关反应方程式:
(1)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。回收废旧磷酸亚铁锂电池正极片[含Al、炭黑、LiFePO4(难溶于水和碱)]中各物质的流程如下图所示:

①写出“碱溶”时的离子方程式:________。
②写出“酸溶”时的化学方程式:________。
③LiFePO4可由Fe2O3、碳粉、LiH2PO4在480℃~900℃时混合共热制得,反应中还有CO生成,写出该反应的化学方程式:________。
(2)羟基自由基(电子式为![]() ,本题用·OH表示)有较强的氧化性,常用于污染物的治理。
,本题用·OH表示)有较强的氧化性,常用于污染物的治理。
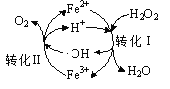
①pH=3时,Fe2+可循环催化H2O2的分解,过程中会产生·OH 中间体,转化过程如右图所示。写出转化Ⅱ的离子方程式:________。
②写出酸性条件下,·OH将水中的乙醛氧化成CO2和H2O的离子方程式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com