
 在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为( )
在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为( )| A、0.5 mol?L─1 |
| B、0.05 mol?L─1 |
| C、1 mol?L─1 |
| D、0.1 mol?L─1 |
| V |
| Vm |
| n |
| V |
| V |
| Vm |
| 0.112L |
| 22.4L/mol |
| n |
| v |
| 0.01mol |
| 0.1L |


科目:高中化学 来源: 题型:
| c(OH-) |
| c(H+) |
| A、溶液中水电离出的c(H+)=10-10mol/L |
| B、溶液中c(HA)+c(A-)=0.1mol/L |
| C、与0.05mol/LNaOH溶液等体积混合所得溶液中离子浓度大小关系为c(H+)<c(OH-)<c(Na+)<c(A-) |
| D、上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
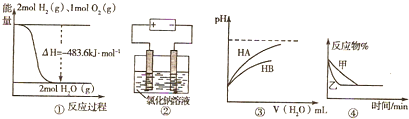
| A、图①表示H2与O2发生反应过程中的能量变化,H2的燃烧热为241.8kJ?mol-1 |
| B、图②是在电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1:1 |
| C、图③表示常温下稀释 HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液 |
| D、图④表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(g) 的影响,乙的压强大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:3:6 |
| B、6:3:2 |
| C、3:2:1 |
| D、1:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+ |
| B、将少量的二氧化硫气体通入次氯酸钠溶液中 SO2+H2O+2ClO-=SO32-+2HClO |
| C、用氢氧化钡溶液中和硫酸氢铵溶液:H++SO42-+Ba2++OH-=H2O+BaSO4↓ |
| D、用纯碱溶液溶解苯酚:CO32-+C6H5OH→HCO3-+C6H5O- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁跟硫酸铜溶液反应:2Fe+3Cu2+=2Fe3++3Cu |
| B、饱和石灰水跟稀硝酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| C、在碳酸氢钙溶液中加入盐酸:CO32-+2H+=CO2↑+H2O |
| D、在澄清石灰水里通入过量二氧化碳:OH-+CO2=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,有关W的信息如图,据此回答下列问题:
,有关W的信息如图,据此回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com