
| ||
| ||
| ||
| △ |
| ||
| △ |
| ||
| △ |
| ||
| ||
| △ |
| ||
| ||
| ||
| ||
| △ |
| ||
| △ |


科目:高中化学 来源:物理教研室 题型:058
NaNO2+NH4Cl=NaCl+N2↑+2H2O
实验室装置如图所示,试回答:
(1)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是________(填写编号)。
a.防止NaNO2饱和溶液蒸发
b.保证实验装置不漏气
c.使NaNO2饱和溶液容易滴下
(2)B部分的作用是________。
a.冷凝 b.冷却氮气 c.缓冲氮气流
(3)加热前必须进行的一个操作步骤是________;加热片刻后,即应移去酒精灯以防反应物冲出,其原因是________。
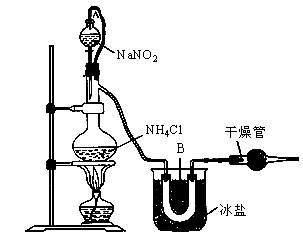
(4)收集N2前,必须进行的步骤是(用文字说明)________,收集N2最适宜的方法是(填写编号)________。
a.用排气法收集在集气瓶中
b.用排水法收集在集气瓶中
c.直接收集在球胆或塑料袋中
查看答案和解析>>
科目:高中化学 来源: 题型:058
实验室常用饱和NANO2与NH4Cl溶液反应制取纯净氮气。反应式为
NaNO2+NH4Cl=NaCl+N2↑+2H2O
实验室装置如图所示,试回答:
(1)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是________(填写编号)。
a.防止NaNO2饱和溶液蒸发
b.保证实验装置不漏气
c.使NaNO2饱和溶液容易滴下
(2)B部分的作用是________。
a.冷凝 b.冷却氮气 c.缓冲氮气流
(3)加热前必须进行的一个操作步骤是________;加热片刻后,即应移去酒精灯以防反应物冲出,其原因是________。
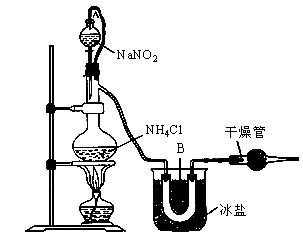
(4)收集N2前,必须进行的步骤是(用文字说明)________,收集N2最适宜的方法是(填写编号)________。
a.用排气法收集在集气瓶中
b.用排水法收集在集气瓶中
c.直接收集在球胆或塑料袋中
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市高三第二次月考化学试卷(解析版) 题型:实验题
(18分)
Ⅰ. 氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。
请回答:
(1)实验室制取氨气的化学方程式是 。
(2)① 如图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是 。
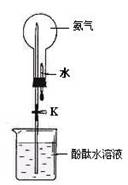
② 氨气使烧杯中溶液由无色变为红色,其原因是(用电离方程式表示) 。
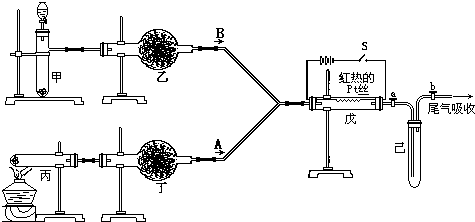
(3)该小组同学设计了下图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。
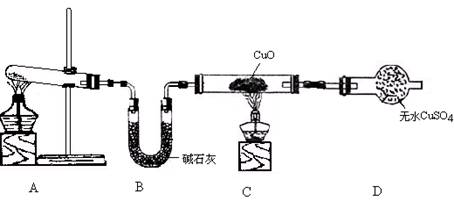
① 实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式 。
② 碱石灰的作用是 。
③ 整套装置在方框处应添加一种装置后,此实验设计才较完善,请在方框中补画出E装置图(要求注明装置中所加试剂名称)。

Ⅱ. 3.2g Cu与30mL,8mol/L过量HNO3反应,硝酸的还原产物为NO,NO2,反应后溶液中所含H+为a mol,则:①此时溶液中所含的NO3-为 mol。
②所生成的NO在标准状况下体积为 L。(以上结果均用含a的代数式表示)
Ⅲ. 某黑色固体甲可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料知道:①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。②硫化铜和硫化亚铜常温下都不溶于稀盐酸。在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图所示的实验:
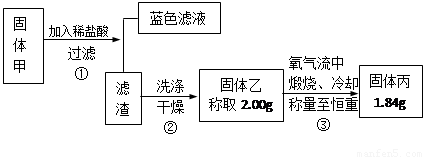
(1)③中在煅烧过程中一定发生的反应的化学方程式为 。
(2)关于固体甲的成分的判断中,下列说法正确的是
A.固体甲中,CuS和Cu2S不能同时存在;
B.固体甲中,CuO和Cu2O至少有一种;
C.固体甲中若没有Cu2O,则一定有Cu2S;
D.固体甲中若存在Cu2O,也可能有Cu2S。
查看答案和解析>>
科目:高中化学 来源:2014届广东省高一上学期期中考试化学试卷 题型:实验题
(16分)实验室需要0.1 mol·L-1NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是____________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。

(2)下列是通过使用质量分数为98%(密度为1.84 g·cm-3)的浓硫酸来配制500 mL 0.5 mol·L-1硫酸溶液的操作步骤,其正确的操作顺序是 (填序号)。
A.把容量瓶活塞塞上,反复摇匀后,装贴标签以保存
B.加入蒸馏水进容量瓶中进行定容,待水面离刻度线只有1~2厘米时,采用胶头滴管滴加蒸馏水使其凹液面正好与刻度线相切
C.在烧杯中注入适量的蒸馏水,用量筒准确量取98%的浓硫酸13.3ml慢慢注入烧杯中,并不停地搅拌使之稀释均匀
D.通过计算需要量取98%(密度为1.84 g·cm-3)的浓硫酸13.3ml
E.待烧杯中稀释的硫酸溶液冷却至室温后,通过玻璃棒引流转移至500ml的容量瓶中
F.把玻璃棒和烧杯分别都洗涤2~3次,洗涤液也转移至容量瓶
(3)根据计算用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol·L-1 (填“大于”“等于”或“小于”,下同);若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.1 mol·L-1;溶解NaOH后在未降至室温时,立即将NaOH溶液转移至容量瓶定容,则所得溶液浓度_______ 0.1 mol·L-1。
(4)在容量瓶的使用方法中,下列操作不正确的是 (填写标号).
A.使用容量瓶前检查它是否漏水.
B.容量瓶用蒸馏水洗净后,不需要进行烘干就可以直接使用.
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线.
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线.
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省新兴县惠能中学高一上学期期中考试化学试卷 题型:实验题
(16分)实验室需要0.1 mol·L-1NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是____________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。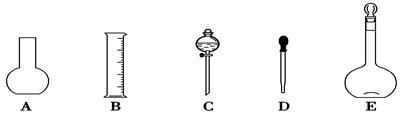
(2)下列是通过使用质量分数为98%(密度为1.84 g·cm-3)的浓硫酸来配制500 mL 0.5 mol·L-1硫酸溶液的操作步骤,其正确的操作顺序是 (填序号)。
A.把容量瓶活塞塞上,反复摇匀后,装贴标签以保存
B.加入蒸馏水进容量瓶中进行定容,待水面离刻度线只有1~2厘米时,采用胶头滴管滴加蒸馏水使其凹液面正好与刻度线相切
C.在烧杯中注入适量的蒸馏水,用量筒准确量取98%的浓硫酸13.3ml慢慢注入烧杯中,并不停地搅拌使之稀释均匀
D.通过计算需要量取98%(密度为1.84 g·cm-3)的浓硫酸13.3ml
E.待烧杯中稀释的硫酸溶液冷却至室温后,通过玻璃棒引流转移至500ml的容量瓶中
F.把玻璃棒和烧杯分别都洗涤2~3 次,洗涤液也转移至容量瓶
次,洗涤液也转移至容量瓶
(3)根据计算用 托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol·L-1 (填“大于”“等于”或“小于”,下同);若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.1 mol·L-1;溶解NaOH后在未降至室温时,立即将N
托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol·L-1 (填“大于”“等于”或“小于”,下同);若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.1 mol·L-1;溶解NaOH后在未降至室温时,立即将N aOH溶液转移至容量瓶定容,则所得溶液浓度_______ 0.1 mol·L-1。
aOH溶液转移至容量瓶定容,则所得溶液浓度_______ 0.1 mol·L-1。
(4)在容量瓶的使用方法中,下列操作不正确的是 (填写标号).
A.使用容量瓶前检查它是否漏水.
B.容量瓶用蒸馏水洗净后,不需要进行烘干就可以直接使用.
C.配制溶液时,如果 试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线.
试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线.
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com