
| A、10Q | B、10Q~5Q |
| C、大于10Q | D、5Q |
| 1 |
| 2 |
| 1 |
| 2 |


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
| A、1:1:1 |
| B、1:2:3 |
| C、6:3:2 |
| D、1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
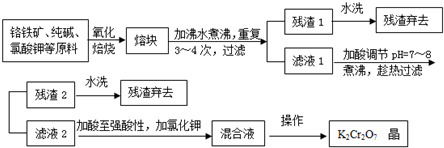
| ||
| ||
| 温 度 | 10℃ | 20℃ | 50℃ | 80℃ | 100℃ |
| K2Cr2O7溶解度(g) | 8.5 | 13.1 | 37.0 | 73.0 | 102.0 |
| NaCl溶解度(g) | 35.8 | 36.0 | 37.0 | 38.4 | 39.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
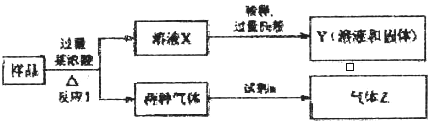
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(Cl-) |
| c(ClO-) |
A、若某温度下,反应后
| ||||||
| B、参加反应的氯气的物质的量等于0.5amol | ||||||
C、改变温度,反应中转移电子的物质的量ne的范围:
| ||||||
D、改变温度,产物中KC1O3的最大理论产量为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 有1,3-丁二烯和氢气的混合气体5L,在催化剂作用下,经充分反应后得到的气体体积为VL(所有体积均在同温、同压下测定).
有1,3-丁二烯和氢气的混合气体5L,在催化剂作用下,经充分反应后得到的气体体积为VL(所有体积均在同温、同压下测定).查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | A1(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 叙述 | 解释 | |
| A | NaCl的熔沸点比KCl低 | NaCl的晶格能小于KCl |
| B | CH4的一氯代物只有一种结构 | CH4是正四面体结构 |
| C | 乙烯容易发生加成反应 | π键键能较小,容易断裂 |
| D | 葡萄糖可以发生银镜反应 | 分子中含有-CHO |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不能透过滤纸 |
| B、有丁达尔效应产生 |
| C、所得液体一定无色透明 |
| D、不稳定、很快会分层 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com