
【题目】A、B、C、D为原子序数依次增大的前四周期元素。BA3能使湿润的红色石蕊试纸变蓝,A、B、C三种原子的电子数之和等于25,D有两种常见氧化物,其中一种颜色是砖红色的。
请回答下列问题:
(1)以上四种元素中,电负性最小的是____(填元素符号);
(2)在BA3、AC中,沸点较高的是____(填化学式),其原因是_____。
(3)B元素组成的常见单质中σ键和π键的个数比是____,D的基态原子的外围电子排布式为______。
(4)化合物BA3的立体构型为_____,其中心原子的杂化轨道类型为_______。
(5)由B、D形成的晶体的晶胞图所示,己知紧邻的B原子与D原子距离为acm。

①该晶胞化学式为_____。
②该晶体的密度为_____gcm-3(用含a、NA的代数式表示,设NA为阿伏加德罗常数值)。
【答案】Cu NH3 NH3分子之间存在氢键 1:2 3d104s1 三角锥形 sp3 Cu3N ![]()
【解析】
BA3能使湿润的红色石蕊试纸变蓝,A是H元素、B是N元素;A、B、C三种原子的电子数之和等于25,则C的电子数是17,C是Cl元素;D有两种常见氧化物,其中一种颜色是砖红色的,D是Cu元素。
(1)金属性越强的元素电负性越小,非金属性越强的元素电负性越大,H、N、Cl、Cu四种元素中,只有Cu是金属,所以电负性最小的是Cu;
(2)NH3可以形成分子间氢键,所以在NH3、HCl中,沸点较高的是NH3。
(3)N2中存在N![]() N,叁键中有1个 σ键和2个π键,σ键和π键个数比是1:2,Cu原子核外有29个电子,基态原子核外电子排布式是1s22s22p63s23p63d104s1,外围电子排布式为3d104s1。
N,叁键中有1个 σ键和2个π键,σ键和π键个数比是1:2,Cu原子核外有29个电子,基态原子核外电子排布式是1s22s22p63s23p63d104s1,外围电子排布式为3d104s1。
(4)NH3中N原子的杂化轨道数是![]() ,N原子杂化轨道类型为sp3,有1个孤电子对,分子立体构型为三角锥形。
,N原子杂化轨道类型为sp3,有1个孤电子对,分子立体构型为三角锥形。
(5)①根据均摊原则,晶胞中N原子数是![]() 、Cu原子数是
、Cu原子数是![]() ,该晶胞化学式为Cu3N。
,该晶胞化学式为Cu3N。
②晶胞的化学式是Cu3N,摩尔质量是206g/mol,紧邻的N原子与Cu原子距离为acm,晶胞的边长是2acm,晶胞他就是![]() 。该晶体的密度为
。该晶体的密度为![]()
![]() gcm-3。
gcm-3。


科目:高中化学 来源: 题型:
【题目】(1) 2016中国首艘国产航母即将竣工,8艘052D驱逐舰下水,加快了我国海军迈向“蓝水海军”的步伐。

①舰艇底部涂有含Cu2O的防腐蚀涂料。Cu2O属于________(填字母)。
a. 复合材料
b. 无机非金属材料
c. 有机高分子材料
②核动力航母中,钠钾合金(常温下呈液态)可用于快中子反应堆导热剂,是利用了钠钾合金性质的________(填字母)。
a. 熔点低、沸点高 b. 导电性好 c. 在空气中性质不稳定
③航母中供水管道多采用PE(聚乙烯)材料,聚乙烯的化学式为________________。
(2)西兰花营养丰富,含蛋白质、淀粉、油脂、叶酸、维生素C和叶绿素,营养成份位居同类蔬菜之首,被誉为“蔬菜皇冠”。

①维生素C俗名为________。在一支盛有2 mL 2%淀粉溶液的试管中滴入2滴碘 水,溶液呈蓝色,再滴入维生素C的水溶液,溶液颜色变为________,该实验说明维生素C具有________性。
②油脂在人体内水解的最终产物是________(写名称)和甘油。
③西兰花成分中可做天然着色剂的是________,属于糖类的是________。
(3) 2016年9月4日,G20峰会召开,扬州天空呈现出干净的蓝色,云彩随意地铺散在天空,纯净透明,出现了持续的“水晶天”。
①目前我国空气质量检测体系包括:PM2.5、SO2、NO2、O3、CO等指标。其中________被认为是引起雾霾天气的元凶;会引起硫酸型酸雨的气体为________。
②NH3催化还原氮氧化合物转化为无污染物质是目前应用最广泛的烟气氮氧化合物脱除技术,写出NH3催化还原NO2反应的化学方程式________________。
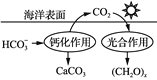
③减少CO2的排放对于环境保护具有重要意义。在海洋碳循环中,可通 过如图所示的途径固碳。写出钙化作用的离子方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(选用)CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-=2CuI↓+I2 而得到。如图所示装置中,a、b都是惰性电极,通电一段时间后,在KI一淀粉溶液中阳极周围变蓝色,则下列说法正确的是

A.若a极变红,则在Pt电极上:2I--2e-=I2碘遇淀粉变蓝
B.若b极变红,在Pt电极上:4OH--4e-=2H2O+O2,O2将I-氧化为I2,碘遇淀粉变蓝
C.若a极变红,在Cu电极上:开始Cu+I--e-=CuI,一段时间后2I--2e-=I2,碘遇淀粉变蓝
D.若b极变红,在Cu极上:Cu-2e-=Cu2+,Cu2+显蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.已知草酸氢钾溶液呈酸性,则在0.1mol·L-1KHC2O4溶液中c(C2O42-)>c(K+)>c(H2C2O4)
B.常温下向氯化铵溶液中加入少量氨水使溶液中c(NH4+)=c(Cl-),则混合液的pH=7
C.常温下,在0.10mol·L-1CH3COOH溶液中加入少量CH3COONa晶体,能使CH3COOH的电离度降低,溶液的pH增大
D.pH=3的0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中:2c(H+)+c(HA)=c(A-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电极反应式或离子方程式与所述事实相符且正确的是( )
A. 用银作电极材料电解氯化铜溶液的阳极反应式:2Cl--2e- =Cl2↑
B. 甲烷碱性燃料电池的负极反应式:CH4 +10OH--8e- =CO32-+7H2O
C. 向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2=2Fe3+ +Br2+4Cl-
D. 向NH4Al(SO4)2溶液中加入Ba(OH)2溶液至恰好使SO42-完全沉淀:Al3+ +2SO42-+2Ba2 ++4OH-=AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用乙烯与甲苯为主要原料,按下列路线可合成有机物E、F:

请回答:
(1)B中官能团的名称是_____,反应④的反应类型是_____。
(2)F的结构简式______________。
(3)反应①的化学方程式是___________,反应⑤的化学方程式是_________。
(4)下列有关说法不正确的是________。
A.![]() 不能使酸性KMnO4溶液褪色
不能使酸性KMnO4溶液褪色
B.E能与新制的Cu(OH)2悬浊液发生反应,但B不能
C.1molE和足量H2反应,最多消耗4molH2
D.D的同分异构体中能与NaOH溶液发生反应的有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,
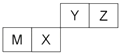
其中只有M为金属元素,下列说法不正确的是( )
A.原子半径Z<M
B.Z位于元素周期表中第二周期、第ⅥA族
C.X的最简单气态氢化物的热稳定性比Z的小
D.X的最高价氧化物不溶于任何酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油化工产品为原料合成聚酯类功能高分子材料R及某药物合成原料E的一种合成路线如下(部分反应条件和产物略去):

已知D与乙醇属于同系物,E在核磁共振氢谱上有3组峰且峰面积比为2∶2∶3
回答下列问题:
(1)Y的名称是____;R的官能团名称是____;E的分子式是__________。
(2)反应Ⅵ的反应类型是_____;X最多有___________个原子共面。
(3)写出II反应的化学方程式__________________。
(4)写出Y的其余几种同分异构体_________________。
(5)已知: ![]() ,参照上述合成路线,以甲苯和溴乙烷为原料合成苯甲酸乙酯,合成路线是:___________。
,参照上述合成路线,以甲苯和溴乙烷为原料合成苯甲酸乙酯,合成路线是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)为元素周期表中的原子序数依次增大的同主族元素。回答下列问题:
(1)N2的电子式为_________;锑在元素周期表中的位置为__________。
(2)![]() 中子数与质子数的差值为________。
中子数与质子数的差值为________。
(3)酸性:H3AsO4__H3PO4(填“>”或”<”)请从元素性质角度解释原因_______。
(4)次磷酸(H3PO2)是一种精细化工产品,具有较强的还原性,可用于化学镀银。
①H3PO2与足量的NaOH溶液反应生成NaH2PO2,则H3PO2是______元酸(填“一”、“二”或“三”)。
②H3PO2可将溶液中的银离子还原为银单质,氧化产物为H3PO4。利用H3PO2进行镀银时,氧化剂与还原剂的物质的量之比为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com