
【题目】某温度下,在 2 L 恒容密闭容器中 3 种物质间进行反应,X、Y、Z 的物质的量随时间的变化曲线如图所示,反应在 t1 min 时达到平衡。
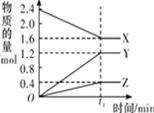
(1)请写出该反应的化学方程式:____________________________
(2)若上述反应中X、Y、Z 分别为NH3、H2、N2的一种,在此t1 min 时间内,用H2 表示该反应的平均速率υ(H2)为____________________________
(3)拆开 1mol 共价键所需吸收的能量如下表:
共价键 | H-H | N≡N | N-H |
吸收的能量/kJ | 436 | 946 | 391 |
1mol N2 完全反应生成NH3__________(填:吸收或放出多少)kJ 能量。但事实上,将 1molN2 和3molH2放在反应容器中,使它们充分反应,反应的热量变化总小于计算值,原因是________________________________
(4)下列叙述能判断该反应达到平衡状态的是___________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.容器内气体的压强不再发生改变
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
【答案】2X3Y+Z 0.6/t1 (mol.L-1.min-1) 放出92 该反应为可逆反应,充分反应的最终结果是达到最大限度时,转化率小于100%,因此放出的热量总是小于理论计算值 ABD
【解析】
(1)分析图像中X、Y、Z物质的量的变化值之比,据此写出该反应的化学方程式;
(2)按定义计算用H2 表示该反应的平均速率υ(H2)即可;
(3)通过表格种的键能数据,反应中放出的热量等于生成物的总键能减去反应物的总键能;反应的热量变化与实际消耗的反应物的物质的量成正比;
(4)按平衡状态的特征“等”、“定”,判断选项即可;
(1)由图象可以看出,X的物质的量逐渐减小,则X为反应物,Y、Z的物质的量逐渐增多,Y、Z为生成物,当反应到达2min时,△n(X)=0.8mol,△n(Y)=1.2mol,△n(Z)=0.4mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(X):△n(Y):△n(Z)=2:3:1,所以反应的化学方程式为:2X3Y+Z;
答案为:2X3Y+Z;
(2)若上述反应中X、Y、Z 分别为NH3、H2、N2的一种,则Y为氢气,在此t1 min 时间内,用H2 表示该反应的平均速率 ;
;
答案为:![]() ;
;
(3)合成氨反应为: ![]() ,实际消耗1molN2、3molH2,生成2molNH3,则消耗1molN2吸收能量946 kJ、消耗3molH2吸收能量3×436 kJ、生成2molNH3放出能量6×391 kJ,则1mol N2 完全反应生成NH3时放出92kJ 能量;
,实际消耗1molN2、3molH2,生成2molNH3,则消耗1molN2吸收能量946 kJ、消耗3molH2吸收能量3×436 kJ、生成2molNH3放出能量6×391 kJ,则1mol N2 完全反应生成NH3时放出92kJ 能量;
答案为:92;
但合成氨反应是可逆反应,当1mol N2 完全反应生成NH3时,实际提供的反应物必定大于1molN2和3molH2,若将1molN2和3molH2放在反应容器中,使它们充分反应,实际不可能完全消耗,故反应的热量变化总小于计算值;
答案为:该反应为可逆反应,充分反应的最终结果是达到最大限度时,转化率小于100%,因此放出的热量总是小于理论计算值;
(4)该反应为2X3Y+Z;
A.容器内各气体组分的质量分数不再发生改变,则各成分的浓度不再变化,已达平衡,A符合;
B.容器内气体的压强不再发生改变,则各成分的物质的量、浓度不再变化,B符合;
C.容器内气体的密度不会随着反应而变化,故密度不再发生改变,不能说明已经平衡,C不符合;
D.气体的物质的量、混合气体的平均相对分子质量会随着反应而变化,故混合气体的平均相对分子质量不再发生改变,则各成分的物质的量不再变化说明已达平衡,D符合;
答案为:ABD。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是核电荷数依次增大的六种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。(请用化学用语回答下列问题)
(1)B在周期表中的位置_______________
(2)F元素的最高价氧化物对应的水化物的化学式为_____。
(3)用电子式表示化合物D2C的形成过程____________。C、D还可形成化合物D2C2,其电子式为____________。
(4)C、E的氢化物,沸点由高到低顺序是:__________其原因是_____________。
(5)写出碳单质与B的最高价氧化物对应水化物浓溶液反应的化学方程式,并用单线桥标明电子的转移方向_________。当转移电子为0.2mol时,标准状况下反应产生气体_______L
(6)已知E单质和F单质的水溶液反应会生成两种强酸,其化学反应方程式为:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列“实际应用”对应“化学知识原理”说法错误的是( )
选项 | 实际应用 | 化学知识原理 |
A | 泡沫灭火器中装有碳酸氢钠溶液 和硫酸铝溶液 | 碳酸氢钠溶液和硫酸铝溶液水解且相互促进 |
B | 工业上采用高压(20-50MPa)合成NH3 | 应用勒夏特列原理 |
C | 施加石膏降低盐碱地(含Na2CO3)的碱性 | CaCO3溶度积小于CaSO4 |
D | 选用金属锂做电池电极材料 | 锂轻且在空气中稳定 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED系列产品是被看好的一类节能新产品,下图是一种氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是
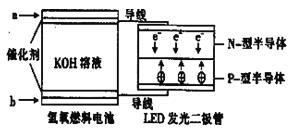
A.a处通入氢气,发生了还原反应:H2-2e-+2OH-=2H2O
B.b处通入氧气,为电池的正极
C.该装置中只涉及两种形式的能量转化,电池中的KOH溶液也可用稀硫酸溶液代替
D.P-型半导体连接的是电池负极.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1000mol/L的盐酸滴定20 mL0.1000mol/L氨水,滴定曲线如下图,下列说法正确的是( )
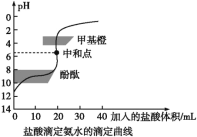
A. 该中和滴定适宜用酚酞作指示剂
B. 两者恰好中和时,溶液的pH=7
C. 达到滴定终点时,溶液中:c(H+)=c(OH-)+c(NH3·H2O)
D. 当滴入盐酸达40 mL时,溶液中c(NH4+)+c(H+)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据以下转化关系,完成以下各空:
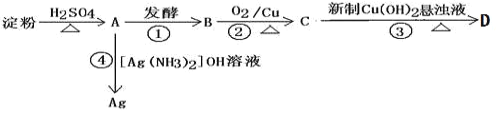
(1) A和C的结构简式:A__________________C________________。
(2) 写出②③的化学方程式:
②_______________________________________________________
③________________________________________________________
(3)④的反应类型_____________
(4)C2H518OH与D酸化后的产物反应的化学方程式______________________。
(5)用饱和碳酸钠溶液收集乙酸乙酯后,分离得到乙酸乙酯的方法是__________,分离需要的玻璃仪器有________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Cu-Zn原电池的装置示意图,下列叙述正确的是( )
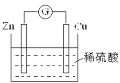
A.Zn片是正极
B.H+在铜片上得电子
C.反应过程中电能转变为化学能
D.电子从锌片通过硫酸溶液流向铜片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雌二醇的结构简式如图,下列说法不正确的是
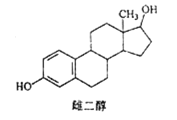
A. 能与 Na、NaOH溶液、Na2CO3溶液反应
B. 能发生加成反应、取代反应、消去反应
C. 该分子中所有碳原子不可能在同一个平面内
D. 可与 FeC13溶液发生显色反应,但不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物的性质和用途的说法正确的是 ( )
A.乙烯分子与苯分子中的碳碳键相同,二者都能发生加成反应
B.乙烷、乙烯、苯乙烯(![]() )分子结构中都含有不饱和碳原子
)分子结构中都含有不饱和碳原子
C.乙醇既可作燃料,也可在日常生活中使用,如一定浓度的乙醇可用于杀菌、消毒
D.淀粉、油脂、蛋白质都属于高分子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com