
【题目】实验室用单质A模拟工业上制备含氧酸D的过程如图所示,已知D为强酸,请回答下列问题。
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了____________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A的化学式是____________;C的化学式是____________。
②D的浓溶液在常温下可与铜反应并生成C气体,反应的化学方程式是_________________________。
【答案】H2SO4 酸雨 N2 NO2 Cu+4HNO3(浓)![]() 2NO2↑+2H2O+Cu(NO3)2
2NO2↑+2H2O+Cu(NO3)2
【解析】
(1)A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体,则B应为SO2,则A为S单质,C为SO3,D为H2SO4;
(2)C是红棕色气体,应为NO2,则A应为N2,B为NO,C为NO2,D为HNO3。
根据上述分析可知,
(1)①A为S单质,则D为H2SO4;
②在工业生产中SO2气体的大量排放会造成酸雨,因此被雨水吸收后会形成酸雨而污染环境;
(2)根据上述分析可知,
①A应为N2,C为NO2;
②浓硝酸与Cu可以反应生成NO2、水和硝酸铜,方程式为Cu+4HNO3(浓)![]() 2NO2↑+2H2O+Cu(NO3)2。
2NO2↑+2H2O+Cu(NO3)2。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】对于0.1 mol/L Na2SO3溶液,下列叙述正确的是
A. c(Na+) : c(SO32―) < 2 : 1
B. c(Na+) = 2 c (SO32―) + c(HSO3―) + c(H2SO3)
C. c(Na+) + c(H+) = 2 c (SO32―) + 2 c(HSO3―) + c(OH―)
D. 加入少量NaOH固体,c(SO32―) 与c(Na+) 均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.增大压强使平衡向生成Z的方向移动,平衡常数增大
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.反应达平衡时,X的转化率为50%
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1molL-1的(NH4)2SO4溶液,用离子方程式表示该溶液显酸性的原因:___,在该溶液中各种离子浓度由大到小的顺序为___。
(2)B为0.1molL-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:__(用离子方程式和必要的文字说明)。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入__,目的是___;若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.66g镁铝合金加入到800mL稀硝酸中,恰好完全反应(假设反应中还原产物只有NO),向所得溶液中加入足量的3mol·L-1NaOH溶液,测得生成沉淀的质量与原合金的质量相等,则下列有关叙述不正确的是
A. 原稀硝酸的浓度为2.6mol·L-1 B. 生成NO的体积为11.648L(标准状况)
C. 反应过程中共消耗1.56molNaOH D. 合金中Al的质量分数约为58.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电子式书写正确的是( )
①氧原子![]() ②过氧根离子
②过氧根离子![]() ③氢氧根离子
③氢氧根离子![]() ④钠离子[Na]+⑤氢离子H+⑥铵根离子
④钠离子[Na]+⑤氢离子H+⑥铵根离子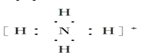 ⑦铝原子
⑦铝原子![]() ⑧溴离子
⑧溴离子![]()
A.①②③⑥⑦B.①③⑥⑦⑧
C.①③⑤⑥⑦⑧D.②③④⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温常压下,l mol乙醇完全燃烧生成气态二氧化碳和液态水时,放出1367kJ的热量,写出该反应的热化学方程式________________________。
(2)在一定条件下,向密闭容器中充入一定量的NO2气体,发生如下的反应:![]() △H<0,达到平衡后,欲使混合气体颜色加深,可采取的措施是____________(填字母代号)
△H<0,达到平衡后,欲使混合气体颜色加深,可采取的措施是____________(填字母代号)
A.加热 B.压缩容器体积 C.加催化剂
(3)写出可逆反应![]() 的平衡常数表达式K=____________。
的平衡常数表达式K=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液(工业利用Cl2与NaOH反应制得)可用于消毒和漂白,下列实验现象的分析不正确的是
实验操作 |
|
|
|
实验现象 | 混合后溶液的pH=9.9,短时间内未褪色,一段时间后蓝色褪去。 | 混合后溶液pH=5.0,蓝色迅速褪去,无气体产生。 | 混合后溶液pH=3.2,蓝色迅速褪去,并产生大量气体,使湿润的淀粉碘化钾试纸变蓝。 |
A.对比实验①和②,②中蓝色迅速褪去的原因是发生了反应ClO+H+═HClO
B.实验③中产生的气体是Cl2,由HClO分解得到:2HClO═Cl2↑+H2O
C.对比实验②和③,溶液的pH可能会影响ClO的氧化性或Cl的还原性
D.加酸可以提高“84”消毒液的漂白效果,但需要调控合适的pH才能安全使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班在实验室进行制取乙酸乙酯并对其性质进行探究的分组实验,主要步骤如下:
I.为探究乙酸乙酯的水解反应,某组同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
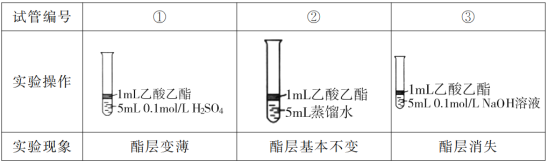
(1)设计实验①和②,是为了探究___对乙酸乙酯的水解的影响。
(2)试管③中反应的化学方程式是__。
Ⅱ.某组同学为验证醋酸、碳酸与苯酚三者酸性的强弱,经过慎重考虑,设计如下实验装置。已知A中装有醋酸,D中装有苯酚钠,请回答问题:
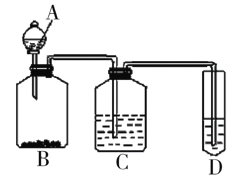
(1)C所盛放的药品是___,装置C的作用___。
(2)试描述能证明三种酸的酸性强弱的实验现象___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com