
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
分析 (Ⅰ)互为逆反应的平衡常数互为倒数,化学计量数为倍数关系时平衡常数为平方关系;
(Ⅱ)(1)根据温度升高,平衡常数变大来分析;
(2)平衡常数为生成物浓度幂之积与反应物浓度幂之积的比;
(3)根据转化率=$\frac{转化的物质的量}{起始物质的量}$×100%计算;
(4)根据浓度和平衡常数来计算平衡常数,从而确定温度;
(5)根据800℃时,$\frac{c(C)•c(D)}{c(A)•c(B)}$与K比较判断反应方向,如果$\frac{c(C)•c(D)}{c(A)•c(B)}$>K,则反应向逆反应方向移动,如果$\frac{c(C)•c(D)}{c(A)•c(B)}$=K,则反应达到平衡状态,如果$\frac{c(C)•c(D)}{c(A)•c(B)}$<K,则反应向正反应方向移动,据此答题.
解答 解:(Ⅰ)448℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数K1为64,则温度下反应2HI(g)?H2(g)+I2(g)的平衡常数K2为$\frac{1}{{K}_{1}}$=$\frac{1}{64}$,
故答案为:$\frac{1}{64}$;64;
(Ⅱ)(1)由温度升高,平衡常数变大可知,升高温度,平衡向正反应方向移动,则正反应为吸热反应,故答案为:吸热;
(2)平衡常数为生成物浓度幂之积与反应物浓度幂之积的比,则CO2(g)+H2(g)?CO(g)+H2O(g)的平衡常数K=$\frac{c(C)•c(D)}{c(A)•c(B)}$,
故答案为:$\frac{c(C)•c(D)}{c(A)•c(B)}$;
(3)平衡后时 c(C)=0.0060mol/L,则CO的物质的量为0.06mol,根据化学方程式可知,反应用去的二氧化碳的物质的量为0.06mol,根据转化率=$\frac{转化的物质的量}{起始物质的量}$×100%可知CO2的转化率为$\frac{0.06}{0.1}$×100%=60%,
故答案为:60%;
(4)c(A)•c(B)=c(C)•c(D)时,平衡常数K=$\frac{c(C)•c(D)}{c(A)•c(B)}$=1,则该温度为830℃,故答案为:830;
(5)$\frac{c(C)•c(D)}{c(A)•c(B)}$=$\frac{1mol/L×3mol/L}{2mol/L×1.5mol/L}$=1>K,所以化学平衡向逆反应方向移动,故答案为:逆向.
点评 本题考查化学平衡的计算,明确平衡常数的计算方法及平衡常数与反应方程式的关系、平衡的判定等即可解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 能电离出H+的化合物都是酸,能电离出OH-的化合物都是碱 | |
| B. | 盐类物质一定含有金属离子 | |
| C. | NH3、CO2水溶液能够导电,所以NH3、CO2是电解质 | |
| D. | 可用丁达尔效应区别NaCl溶液和Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
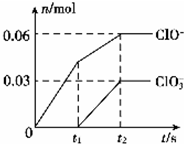 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与 反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与 反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A. | 反应中转移电子的物质的量是0.21mol | |
| B. | ClO3-的生成可能是由于温度升高引起的 | |
| C. | 苛性钾溶液中KOH的质量是16.8g | |
| D. | 一定有3.36L氯气参加反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ MnO4- Cl- SO42- | B. | Na+ K+ NH4+ Ba2+ | ||
| C. | Na+ HCO3- NO3- SO42- | D. | Na+ SO42- CO32- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往NaHC2O4溶液中通入氨气至中性:c(H2C2O4)+c(NH4+)>c(C2O42-) | |
| B. | 将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)变小 | |
| C. | 常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后过滤,所得滤液中存在:c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | 在同浓度的HCN和NaCN的混合溶液中,若pH>7,则c(HCN)<c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到平衡后,若只升高温度,化学平衡正向移动 | |
| B. | 达到平衡后,再通入稀有气体,逆反应速率增大 | |
| C. | 使用催化剂,平衡常数不变 | |
| D. | 0~5 min内,NO的反应速率为2.4×1 0-3 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .(提示:该反应的逆反应原子利用率为100%)
.(提示:该反应的逆反应原子利用率为100%) ;
; 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com