
 现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大.A的原子半径最小;B的原子有6个运动状态不同的电子;D、E两元素同主族,且E的原子核外电子数是D的2倍;F是前四周期中未成对电子数最多的元素;G原子内层轨道全排满电子,最外层电子数为2.根据以上信息,回答下列问题:
现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大.A的原子半径最小;B的原子有6个运动状态不同的电子;D、E两元素同主族,且E的原子核外电子数是D的2倍;F是前四周期中未成对电子数最多的元素;G原子内层轨道全排满电子,最外层电子数为2.根据以上信息,回答下列问题: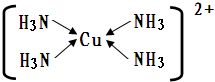 ;
;分析 A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大.A的原子半径最小,则A为H元素;B的原子有6个运动状态不同的电子,则B为碳元素;D、E两元素同主族,且E的原子核外电子数是D的2倍,则D为O元素、E为S元素;C的原子序数介于碳、氧之间,故C为N元素;F是前四周期中未成对电子数最多的元素,外围电子排布式为3d54s1,故F为Cr元素;G原子内层轨道全排满电子,最外层电子数为2,核外电子数为2+8+18+2=30,故G为Zn.
解答 解:A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大.A的原子半径最小,则A为H元素;B的原子有6个运动状态不同的电子,则B为碳元素;D、E两元素同主族,且E的原子核外电子数是D的2倍,则D为O元素、E为S元素;C的原子序数介于碳、氧之间,故C为N元素;F是前四周期中未成对电子数最多的元素,外围电子排布式为3d54s1,故F为Cr元素;G原子内层轨道全排满电子,最外层电子数为2,核外电子数为2+8+18+2=30,故G为Zn.
(1)F是前四周期中未成对电子数最多的元素,外围电子排布式为3d54s1,G为Zn元素,处于周期表中第四周期IIB则,属于ds区元素,
故答案为:3d54s1;ds;
(2)同周期随原子序数增大元素第一电离能呈增大趋势,但N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:C<O<N,
故答案为:C<O<N;
(3)NH3分子中N原子价层电子对数为3+$\frac{5-1×3}{2}$=4,故VSEPR模型是正四面体形;氨气分子与水分子都是极性分子,相似相溶,氨气分子与水分子形成分子间氢键,故NH3极易溶于水,
故答案为:正四面体;氨气分子与水分子都是极性分子,相似相溶;氨气分子与水分子形成分子间氢键;
(4)向CuSO4溶液中滴加过量NH3的水溶液,可生成一种深蓝色离子[Cu(NH3)4]2+,其结构示意图为: ,
,
故答案为: ;
;
(5)化合物NH5属于离子晶体,为NH4H,配合粒子中H+提供空轨道,氨气分子提供孤电子对,中心原子是H+,故答案为:H+;
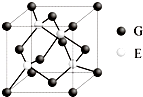
(6)晶胞中S原子数目为4,Zn原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故化学式为ZnS,Zn2+的配位数为4,为1:1型化合物,故E2-的配位数为4,晶胞质量为4×$\frac{M}{{N}_{A}}$g,晶胞体积为a3,则晶体密度为ρ=4×$\frac{M}{{N}_{A}}$g÷a3cm3=$\frac{4M}{{{a^3}{N_A}}}$g/cm3,
故答案为:ZnS;4;$\frac{4M}{{{a^3}{N_A}}}$.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、价层电子对互斥理论、氢键、分子结构与性质、配合物、晶胞结构与计算等,是对学生综合能力的考查,难度中等.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 尽管氯气的化学性质很活泼,但是纯净的液氯能用钢瓶贮存 | |
| B. | 欲除去CO2中的大量HCl气体,可将此混合气体通过盛有饱和NaHCO3溶液的洗气瓶 | |
| C. | 漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存 | |
| D. | 新制的氯水中加入AgNO3溶液,有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别向Na2CO3和NaHCO3溶液中逐滴加入稀盐酸至过量,产生的现象相同 | |
| B. | 分别向AlCl3溶液中逐滴加入NaOH溶液和氨水至过量,产生的现象相同 | |
| C. | 分别将FeO和Fe2O3溶于稀硝酸中,再加入KSCN溶液,溶液的颜色不同 | |
| D. | 分别向FeCl2和MgCl2溶液中,加入NaOH溶液至过量,沉淀的颜色不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
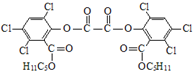 “魔棒”常用于晚会气氛的渲染,其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后发光.草酸二酯(CPPO)结构简式如下图所示,请回答下列问题:
“魔棒”常用于晚会气氛的渲染,其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后发光.草酸二酯(CPPO)结构简式如下图所示,请回答下列问题: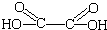 ).
).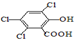 )在催化剂和适当条件下可以生成CPPO,
)在催化剂和适当条件下可以生成CPPO,| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(s) 质量(g) | 褪色时间(S) | ||
| C(mo•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
 .类似的
.类似的 ,也可以发生反应生成N,则N结构简式为
,也可以发生反应生成N,则N结构简式为 (写出其中的一种).
(写出其中的一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

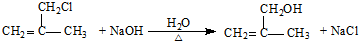 ;⑨的化学方程式是
;⑨的化学方程式是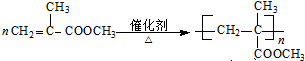 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com