
水溶液中存在多种平衡,请根据所学化学知识回答下列问题:
(1)在浓度均为0.1mol/L①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为 (填序号)
(2)浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(3)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH= 。
(1)④>②>①>③(2)④>②>③>①(3)11
【解析】
试题分析:(1)在浓度均为0.1mol/L①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4溶液中,NH3?H2O为弱电解质,电离是微弱的,而CH3COONH4 、NH4HSO4 、(NH4)2SO4为强电解质,全部电离,所以NH3.H2O中NH4+浓度最小;(NH4)2SO4含有两个NH4+,则(NH4)2SO4中NH4+浓度最大;NH4HSO4电离产生氢离子,NH4+水解受到抑制,CH3COONH4中醋酸根水解呈碱性,NH4+水解得到促进,则NH4HSO4中NH4+浓度大于CH3COONH4中NH4+浓度;故NH4+浓度由大到小的顺序为 ④>②>①>③;(2) 浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵四种溶液,氯化铵为强酸弱碱盐,发生水解,促进水的电离,由水电离出的H+浓度最大;硫酸、醋酸抑制水的电离,酸溶液比较水电离产生的氢离子,可比较溶液中氢氧根的浓度,硫酸为强酸,全部电离,0.1 mol·L-1的硫酸中氢离子浓度为0.2mol·L-1,氢氧根浓度为5×10—14mol·L-1,醋酸为弱酸,0.1 mol·L-1醋酸溶液中氢离子浓度远小于0.1 mol·L-1,氢氧根浓度远大于1×10—13mol·L-1;氢氧化钠抑制水的电离,碱溶液比较水电离产生的氢离子,可比较溶液中氢离子的浓度,0.1 mol·L-1氢氧化钠溶液中氢氧根浓度为0.1 mol·L-1,溶液中氢离子浓度为1×10—13mol·L-1;综上所述,四种溶液中由水电离出的H+浓度由大到小的顺序是④>②>③>①;(3)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,发生反应2Na+2H2O=2NaOH+H2↑,生成0.1mol氢氧化钠,再加蒸馏水稀释到1L,所得溶液中氢氧根浓度为0.1 mol·L-1,该温度下蒸馏水的pH=6,则水的离子积常数为1×10—12,则溶液中氢离子浓度为1×10—11mol·L-1,pH=11。
考点:考查电解质溶液,涉及水的电离、盐类水解及PH计算。


科目:高中化学 来源:2015届河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:选择题
电解硫酸溶液时,放出25mL(标况)O2,若以等量的电量在同样条件下电解盐酸溶液,
所放出的气体的体积最接近下列数据中的
A.45mL B.50mL C.75mL D.100mL
查看答案和解析>>
科目:高中化学 来源:2015届河北省高二下学期第一次月考化学试卷(解析版) 题型:选择题
加拿大阿尔贡天文台在星际空间发现了HC9N链状分子,其结构式为:
HC≡C—C≡C—C≡C—C≡C—C≡N,这是人类迄今发现的最重星际有机分子,有关该分子的说法不正确的是
A.该物质属于不饱和烃
B.该分子中所有原子处在一条直线上
C.该分子在一定条件下可发生加成反应
D.该分子碳、氮原子均满足八电子结构
查看答案和解析>>
科目:高中化学 来源:2015届江西赣州市高二上学期期末联考化学试卷(解析版) 题型:选择题
已知可逆反应:M(g)+N(g) P(g)+Q(g) △H>0 。反应达到平衡后,若要增大M的转化率,在其它条件不变的情况下可以采取的措施为( )
P(g)+Q(g) △H>0 。反应达到平衡后,若要增大M的转化率,在其它条件不变的情况下可以采取的措施为( )
①加入一定量的M ②加入一定量的N ③升高反应体系的温度 ④缩小容器体积
⑤加入某物质作催化剂 ⑥分离出一定量的P
A.① ③ ⑤ B.② ④ ⑥ C.② ③ ⑥ D.④ ⑤ ⑥
查看答案和解析>>
科目:高中化学 来源:2015届江西省赣州市六校高二上学期期末联考化学试卷(解析版) 题型:填空题
据《辽沈晚报》报道,今年冬天,一旦出现大气严重污染的天气,沈阳市有可能建议政府机关、企事业单位根据实际情况实行员工休假或弹性工作制。大气含有的CO、氮氧化物、SO2、烟尘等污染是导致雾霾天气的原因之一,化学反应原理是减少和控制雾霾天气的理论依据。
(1)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(2) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,,负极反应方程式为:___________________。
(3) 利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
(5)已知在常温常压下:
①CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H= -359.8 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) ?△H= -556.0 kJ·mol-1
③ H2O(g)=H2O(l)? △H= -44.0 kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届江西省赣州市六校高二上学期期末联考化学试卷(解析版) 题型:选择题
可逆反应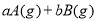

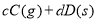
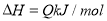 ,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示。据图分析,以下说法正确的是( )
,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示。据图分析,以下说法正确的是( )
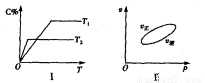
A.T1<T2,Q>0
B.增大压强,物质B的转化率增大
C.反应达平衡后,增加少量的D,平衡逆向移动
D.a+b>c+d
查看答案和解析>>
科目:高中化学 来源:2015届江西省赣州市六校高二上学期期末联考化学试卷(解析版) 题型:选择题
能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是( )
①稀释时,溶液中c(OH-)增大
②溶液的pH<7
③溶液中c(Na+)=c(A2-)
④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应
A.①②④ B.①③④ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高二上学期期末考试化学试卷(解析版) 题型:选择题
水是一种极弱的电解质,在室温下,KW=1×10-14,则此时水的电离百分数为:
A.1×10-7 B.1/55.6 C.10-14 D. 1/(55.6×107)
查看答案和解析>>
科目:高中化学 来源:2015届江苏省扬州市高二下学期学业水平模拟化学试卷(二)(解析版) 题型:选择题
短周期元素A、B、C、D的原子序数依次增大,A的原子半径在所有原子中最小,B位于第VA族,A和C同主族,D原子最外层电子数与电子层数相等。下列叙述正确的是
A.原子半径:C<B
B.元素A、C的氧化物均为共价化合物
C.金属性:D>C
D.元素B、C、D的最高价氧化物对应水化物能相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com