
【题目】某无色透明溶液,可能含有下列离子:Mg2+、A13+、Fe3+、Ba2+、H+、NH4+、SO42-、HCO3-、Cl-。取该溶液进行如下实验:①取溶液少许,滴入AgNO3溶液产生白色沉淀;②取溶液少许,滴入BaCl2溶液产生白色沉淀,加入足量稀硝酸沉淀不溶解;③取一定量的原溶液,加入一种淡黄色粉末状的固体X,产生气体的物质的量(n气体)、沉淀的物质的量(n沉淀)与加入淡黄色粉末的量(nx)的关系如下图所示(假设生成的气体全部逸出)。
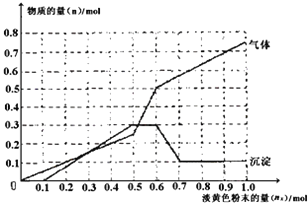
根据实验现象和数据分析正确的是
A. 溶液中肯定大量存在的阳离子只有Mg2+、A13+、NH4+
B. 溶液中肯定没有的离子只有Fe3+、Ba2+
C. 当加入0.6mol淡黄色粉末时,生成两种气体分别为NH3和O2,其对应的体积比为2:3
D. 溶液中可能存在Cl-、HCO3-
【答案】C
【解析】无色溶液中一定不存在有色的Fe3+,根据①滴入AgNO3溶液产生白色沉淀可知,原溶液中可能含有的离子为:SO42-、HCO3-、Cl-;根据②滴入BaCl2溶液产生白色沉淀,加入足量稀硝酸沉淀不溶解,该白色沉淀为硫酸钡,说明原溶液中一定存在SO42-,根据离子共存,一定不存在Ba2+;③根据图象变化,加入淡黄色粉末,立刻生成气体,开始时没有沉淀,之后沉淀逐渐增加,当加入0.5~0.6mol过氧化钠时没有沉淀生成,说明此时参加反应的离子为NH4+,之后沉淀部分溶解,溶解的沉淀为氢氧化铝,证明原溶液中一定存在Mg2+、Al3+;根据离子共存可知,一定不存在HCO3-;淡黄色粉末X为过氧化钠,原溶液中一定存在H+离子,根据以上分析可知,原溶液中一定存在的离子为:Mg2+、Al3+、H+、NH4+、SO42-,原溶液中一定不存在的离子为:Fe3+、Ba2+、HCO3-,可能存在氯离子。X为过氧化钠,当加入0.6mol淡黄色粉末时,生成氨气消耗过氧化钠的物质的量为0.6mol-0.5mol=0.1mol,说明铵根离子消耗了0.2mol氢氧化钠,溶液中含有铵根离子的物质的量为0.2mol,生成氨气的物质的量为0.2mol;根据反应2Na2O2+2CO2=2Na2CO3+O2,0.6mol过氧化钠完全反应生成了0.3mol氧气,所以生成的氨气与氧气的体积之比就等于物质的量之比:0.2mol:0.3mol=2:3,答案选C。


 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】有关物质的量的计算
(1) 1mol HCl中含有HCl分子的个数是_______________________,1.204×1023个CH4分子的物质的量是____________mol。
(2)17克NH3的物质的量是 ______ mol,0.1mol H2O的质量是______________________g。
(3)标准状况下,11.2L O2的物质的量是 ______ mol ,1mol O2的体积是 ______ L。
(4)将8g NaOH配制成1L溶液,其物质的量浓度为_______________mol/L,1L 1mol/L NaOH溶液中含有溶质NaOH的质量是______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用下图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体VmL。下列说法正确的是
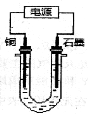
A.铜电极连接电源正极
B.黑色粉末X是铁粉
C.铜的相对原子质量的计算式是![]()
D.石墨电极上发生的反应是4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 电解精炼铜,当外电路通过NA个电子时;阳极质量减少32 g
B. 反应3H2(g)+N2(g) ![]() 2NH3(g) △H=-92kJ·mol-1,当放出热量 9.2 kJ时,转移电子0.6 NA
2NH3(g) △H=-92kJ·mol-1,当放出热量 9.2 kJ时,转移电子0.6 NA
C. lmol·L-1的氯化铜溶液中,若Cl-的数目为2Na,则Cu2+的数目为Na
D. 标准状况下,NO和O2各11. 2L混合充分反应,所得气体的分子总数为0.75 Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A、B、C、D、E均为有机化合物。己知:同温同压下,同质量的C和D的蒸汽所占体积相同,C不能发生催化氧化,D能与NaHCO3溶液发生反应。

根据图示回答下列问题:
(1)C的名称是_____________________。
(2)化合物B能发生的反应是_______________。(填字母序号)
a.加成反应 b.氧化反应 c.消去反应 d.酯化反应 e.水解反应
(3)写出E的结构简式_______________。
(4)写出反应①的化学方程式:______________________________。
(5)同时符合下列三个条件的B的同分异构体有____________种,
a.苯环上有两个取代基且苯环上的一氯代物有两种
b.能与FeCl3溶液发生显色反应
c.能发生水解反应
其中能发生银镜反应的结构简式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 标准状况下,11.2LSO2气体中含氧原子数等于18g水中含有的氧原子数
B. 5.6 g铁与足量稀硫酸反应失去的电子的物质的最为0.3 mol
C. 100g98%的浓硫酸所含的氧原子个数为4mol
D. 20gNaOH溶于1L水,所得溶液中c(Na+)=0.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质和用途具有对应关系的是( )
A. 液氨汽化时吸收大量的热,可用作制冷剂 B. 浓硫酸具有脱水性,可用于干燥气体
C. 二氧化硅熔点高,可用于制光导纤维 D. Al2O3可溶于强酸强碱,可用作耐火材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国四川盛产五倍子,五倍子在药物合成上有很大的作用,以五倍子为原料可制得化合物X.X的结构简式如图所示,下列叙述中错误的是( )

A. X分子中至少含有4种官能团
B. 1 mol X最多能与4 molBr2反应、最多能与8 mol NaOH溶液反应
C. 1mol X水解后能生成2mol 相同的有机物
D. X是一种难溶于水的芳香族有机化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHC2O4溶液的pH < 7。常温下,向pH=8.4的Na2C2O4溶液中滴加0.1mol/L的HCl溶液,溶液pH与pOH[pOH=-lgc(OH-)]的变化关系如图所示,下列各点所示溶液中微粒的物质的量浓度关系一定正确的是

A. a点:c(H+)+c(HC2O4-)+2c(H2C2O4)=c(OH-)
B. b点:c(Cl-)>c(H2C2O4)+c(HC2O4-)+c(C2O42-)
C. c点:c(Na+)=c(HC2O4-)+ c(C2O42-)+c(Cl-)
D. d点:c(OH-)+ c(Cl-)>c(H+)+2c(H2C2O4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com