
【题目】如图为氢氧燃料电池原理示意图,按照此图的提示,回答下列问题 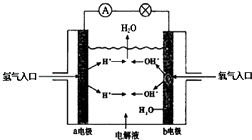
(1)a电极为极,b电极为极
(2)写出该电池的电极反应:负极:正极:
【答案】
(1)负;正
(2)酸性环境下:2H2﹣4e﹣=4H+;碱性环境:2H2﹣4e﹣+4OH=4H2O;碱性环境下:O2+2H2O+4e﹣=4OH﹣ , 酸性环境下:O2+4H++4e﹣=2H2O
【解析】解:(1)燃料电池中,通入燃料氢气的电极a是负极,所以a电极是负极,b是正极,所以答案是:负;正;(2)a电极为负极,负极上氢气失电子发生氧化反应,酸性环境下,则负极的电极反应式为:2H2﹣4e﹣=4H+;b电极为正极,正极上氧气得电子发生还原反应,则正极的电极反应式为:O2+4H++4e﹣=2H2O,碱性环境下,负极上:2H2﹣4e﹣+4OH=4H2O;正极上:O2+2H2O+4e﹣=4OH﹣ , 所以答案是:酸性环境下:2H2﹣4e﹣=4H+;碱性环境:2H2﹣4e﹣+4OH=4H2O;正极上:碱性环境下:O2+2H2O+4e﹣=4OH﹣ , 酸性环境下:O2+4H++4e﹣=2H2O.


科目:高中化学 来源: 题型:
【题目】下列电离方程式中正确的是( )
A.NaHSO4溶于水:NaHSO4Na++H++SO42﹣
B.次氯酸电离:HClO═ClO﹣+H+
C.HF溶于水:HF+H2OH3O++F﹣
D.NH4Cl溶于水:NH4++H2ONH3H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图,回答下列问题: 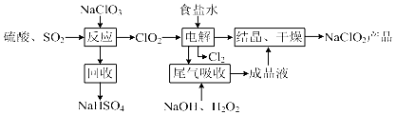
(1)ClO2的沸点为283K,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下更安全.写出“反应”步骤中生成ClO2的化学方程式 .
(2)“尾气吸收”是吸收“电解”过程排出的少量ClO2 .
①在尾气吸收过程中,可代替H2O2的试剂是(填序号).
A.Na2O2B.Na2S C.FeCl2D.KMnO4
②提高尾气的吸收效率的可行措施有(填序号).
A.尾气吸收时充分搅拌吸收液B.适当加快尾气的通入速率C.将温度控制在20℃以下D.加水稀释尾气吸收液
③此吸收反应中,氧化剂与还原剂的物质的量之比为 .
(3)在碱性溶液中NaClO2比较稳定,在酸性溶液中,ClO2﹣和H+合为HClO2 , HClO2
是唯一的亚卤酸,不稳定,易分解产生Cl2、ClO2和H2O,写出HClO2分解的化学方程式: .
(4)已知NaClO2的溶解度随温度升高而增大,NaClO2饱和溶液在38℃以上60℃以下会析出NaClO2 , 在NaClO2析出过程中可能混有的杂质是(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应A(g)+3B(g)2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是( )
A.vA=vB
B.vA=2vC
C.3vB=vC
D.vB=3vD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行过滤操作时应选用的一组仪器及用品是
A.玻璃棒、滤纸、烧瓶、漏斗、铁架台
B.滤纸、烧杯、试管夹、漏斗、玻璃棒
C.漏斗、玻璃棒、烧杯、铁架台、滤纸
D.烧杯、酒精灯、试管、铁架台、漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,向某V L的密闭容器中充入3molH2(g)和3molI2(g),发生反应:
H2(g)+I2(g)2HI(g)△H=﹣26.5kJmol﹣1 ,
测得各物质的物质的量浓度与时间变化的关系如图所示.请回答下列问题: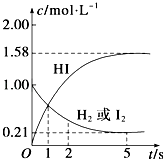
(1)V=L.
(2)该反应达到最大限度的时间是S,该时间内平均反应速率v(HI)=mol/(Ls).
(3)该反应达到平衡状态时,(填“吸收”或“放出”)的热量为kJ.
(4)判断该反应达到平衡的依据是(填序号).①H2消耗的速率和I2消耗的速率相等 ②H2、I2、HI的浓度比为1:1:2
③H2、I2、HI的浓度都不再发生变化④该条件下正、逆反应速率都为零
⑤混合气体的平均分子量不再发生变化 ⑥气体的颜色不再发生变化.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com