
 .
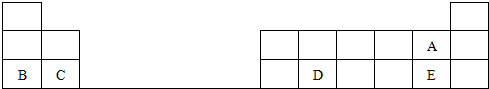
.分析 由元素在在周期表的位置可知,A、B、C、D、E分别为F、Na、Mg、Si、Cl,
(1)D的原子结构中有3个电子层,最外层电子数为4;
(2)非金属性越强,氢化物越稳定;
(3)同周期,从左向右原子半径减小;
(4)Na与水反应生成NaOH和氢气.
解答 解:由元素在在周期表的位置可知,A、B、C、D、E分别为F、Na、Mg、Si、Cl,
(1)D的原子结构中有3个电子层,最外层电子数为4,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)非金属性A>E,氢化物的稳定性为HA>HE,故答案为:>;
(3)同周期,从左向右原子半径减小,则原子半径为B>C,故答案为:>;
(4)Na与水反应生成NaOH和氢气,反应为2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素的性质及元素化合物知识等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氧化铁可用作红色油漆和涂料 | B. | 硅胶可作干燥剂 | ||
| C. | 纯碱可作糕点的发酵粉 | D. | 过氧化钠作呼吸面具供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
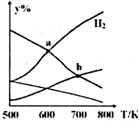 以CO2和H2为原料制取乙醇的反应为:2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g)△H<0.某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下,达到平衡后平衡体系中各物质的物质的量分数(y%)随温度变化如图所示.下列说法正确的是( )
以CO2和H2为原料制取乙醇的反应为:2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g)△H<0.某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下,达到平衡后平衡体系中各物质的物质的量分数(y%)随温度变化如图所示.下列说法正确的是( )| A. | a点的平衡常数小于b点 | B. | b点:v正(CO2)=v逆(H2O) | ||
| C. | a点:n(H2)=n(H2O) | D. | 温度不变,充入更多H2,D(CO2)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
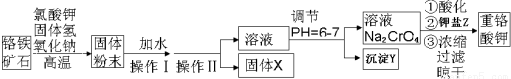
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl | |
| B. | CH2=CH2+HBr→CH3CH2Br | |
| C. |  | |
| D. | CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
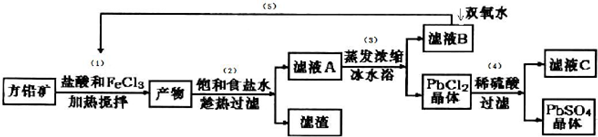

| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
| 处理前浓度/(mg•L-1) | 0.100 | 29.8 | 0.12 | 0.087 |
| 处理后浓度/(mg•L-1) | 0.004 | 22.6 | 0.04 | 0.053 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
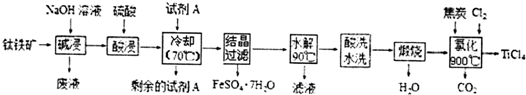
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
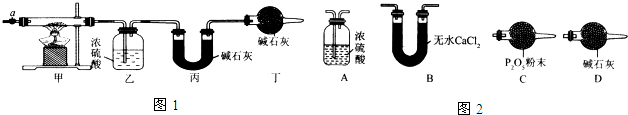
| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
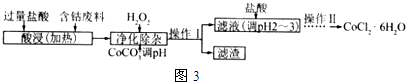
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
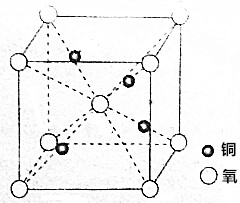 铜的一种氧化物在陶瓷涂色等方面有重要应用,它的晶胞如图所示.
铜的一种氧化物在陶瓷涂色等方面有重要应用,它的晶胞如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com