
【题目】阿司匹林的结构简式如右图: 
根据这一信息,回答下列问题:。
(1) 写出阿司匹林的分子式:______________________________________
(2) 根据结构,推测阿司匹林的性质,下列试剂中,不能与阿司匹林反应的是 (_______)
A、氢氧化钠溶液 B、硫酸钠溶液 C、碳酸钠溶液 D、稀硫酸
(3) 阿司匹林是一种人工合成药物,化学上用水杨酸与乙酸酐(CH3CO)2O反应来制取阿司匹林。请用化学反应方程式表示这个过程:__________________________________________________________
(4)阿司匹林与NaOH反应可以得到可溶性钠盐,有比阿司匹林更好的疗效。请写出此反应的方程式:__________________________________________________________
(5) 有四种常见药物 ①阿司匹林 ②青霉素 ③胃舒平 ④麻黄碱。请回答:
①某同学胃酸过多,应选用的药物是________(填序号)。
抗酸药是治疗胃酸过多的一类药品,请写出一种抗酸药与胃酸反应的化学方程式:_________________________________________________________
②由于具有兴奋作用,国际奥委会严禁运动员服用的药物是________(填序号)。
③从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是________(填序号)。
④滥用药物会导致不良后果,如过量服用________(填序号)会出现水杨酸中毒,应立即停药,并静脉注射NaHCO3
【答案】C9H8O4 B 
 Al(OH) 3+3HCl=AlCl3+3H2O NaHCO3 + HCl = NaCl + CO2↑ + H2O ④ ② ①
Al(OH) 3+3HCl=AlCl3+3H2O NaHCO3 + HCl = NaCl + CO2↑ + H2O ④ ② ①
【解析】
(1)由结构式写出化学式;
(2) 中含酯基、-COOH,结合酯基及羧酸的性质分析;
中含酯基、-COOH,结合酯基及羧酸的性质分析;
(3)水杨酸与乙酸酐(CH3CO)2O发生取代反应来制取阿司匹林;
(4)阿司匹林上羧基与NaOH反应可以得到可溶性钠盐;
(5)①药物的成分及与酸的反应;
②麻黄碱的成分含有能使人兴奋的作用;
③青霉素属于消炎常用药物,使用前需要做皮肤敏感性测试;
④阿司匹林为常用的感冒用药,过量服用会造成酸中毒.
(1)由结构式 写出阿司匹林的分子式:C9H8O4;
写出阿司匹林的分子式:C9H8O4;
(2) 中含酯基、-COOH,A、酯基和羧基能与氢氧化钠溶液反应,故A不符;B、硫酸钠溶液不能与官能团作用,故B选;C、羧基和碳酸钠溶液反应,故C不符;D、稀硫酸作用下酯水解,故D不选。故选B;
中含酯基、-COOH,A、酯基和羧基能与氢氧化钠溶液反应,故A不符;B、硫酸钠溶液不能与官能团作用,故B选;C、羧基和碳酸钠溶液反应,故C不符;D、稀硫酸作用下酯水解,故D不选。故选B;
(3)水杨酸与乙酸酐(CH3CO)2O发生取代反应来制取阿司匹林,反应方程式为 ;
;
(4)阿司匹林上羧基与NaOH反应可以得到可溶性钠盐,反应方程式为: ;
;
(5)①因胃酸的成分为盐酸,治疗胃酸过多则选择胃舒平,因氢氧化铝可与胃酸反应,若不是胃溃疡的病人,也可服用含小苏打的药物,发生的反应为:Al(OH) 3+3HCl=AlCl3+3H2O 或. NaHCO3 + HCl = NaCl + CO2↑ + H2O;
②麻黄碱是一种生物碱,麻黄碱的成分含有能使人兴奋的作用,国际奥委会严禁运动员服用,故选④;
③青霉素是应用广泛的抗菌药物,它本身毒性很小,而较常见的却是药物的过敏,引起不良的反应以致死亡,则使用前要进行皮肤敏感性测试,故选②;
④阿司匹林为常用的感冒用药,但因其含有水杨酸,服用过量易造成酸中毒,可静脉注射NaHCO3来降低酸性,故选①.


科目:高中化学 来源: 题型:
【题目】利用氢气对废气进行脱碳处理可实现绿色环保、废物利用,对于减少雾霾也具有重要意义。
(1)汽车尾气的主要污染物为NO,用H2催化还原NO可以达到消除污染的目的。
已知:2NO(g) ![]() N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是______________。
(2)某研究小组模拟研究如下:向2 L恒容密闭容器中充入2 mol NO发生反应2NO(g) ![]() N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:

①T2下,在0~5 min内,v(O2)=______________mol·L-1·min-1;该温度下反应N2(g)+O2(g) ![]() 2NO(g)的平衡常数K=______________。
2NO(g)的平衡常数K=______________。
②该反应进行到M点放出的热量______________进行到W点放出的热量(填“>”、“<”或“=”)。
M点时再加入一定量NO,平衡后NO的转化率______________(填“变大”、“变小”或“不变”)。
③反应开始至达到平衡的过程中,容器中下列各项发生变化的是______________(填序号)。
a.混合气体的密度 b.逆反应速率
c.单位时间内,N2和NO的消耗量之比 d.气体的平均相对分子质量
(3)氢气作为一种理想燃料,但不利于贮存和运输。利用氢能需要选择合适的储氢材料,镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g) ![]() LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
A.增加LaNi5H6(s)的量 B.升高温度
C.使用催化剂 D.减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)研究氯气跟金属的反应时,选用金属铜进行实验。用坩埚钳夹住一束铜丝,灼热后立刻放入充满氯气的集气瓶里。铜丝燃烧后把少量水注入集气瓶里,用玻璃片盖住瓶口,振荡。
①根据哪些实验现象可判断铜丝燃烧后生成了+2价铜的化合物:_______________。
②反应的化学方程式为______________________________________________________。
(2)研究浓硫酸的强氧化性时,选用金属铜跟浓硫酸进行实验,实验装置如下图所示。
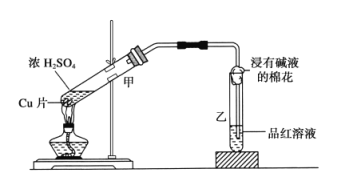
①乙中的现象_______,试管中的浸有碱液的棉花的作用是____________。
②甲中的反应方程式为_____________________________________。
(3)上述两个实验为什么都选金属铜作样本来进行实验________。
A.铜是一种不活泼金属
B.选用铜作实验可以推测更多金属跟氯气或浓硫酸反应的情况
C.铜是一种常见金属
D.铜跟氯气或浓硫酸反应可生成有色溶液,现象明显
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答:
(1)该反应为____________(填“吸热”或“放热”)反应。
(2)该反应的化学平衡常数表达式为K =_________________________________。
(3)能说明该反应达到化学平衡状态的是________________(填字母)。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,将CO2和H2各0.10 mol充入该容器中,达到平衡后,
测得 c(CO) = 0.0080 mol/L ,则CO2的转化率为______________。
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ___________℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料的不断发展可以促进社会进步:
(1)玻璃是常见的硅酸盐产品,制玻璃发生的主要反应为_________,__________。
(2)钢化玻璃是一种常见的玻璃产品,其主要成分为_______________。
我们看到的玻璃,一般都呈淡绿色,只是因为原料中混有____________。
(3)插座也是一种塑料,它有绝缘性好,耐热,抗水等优点。它属于热____性塑料。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质M是一种酰胺类局麻药,某研究小组以A、E两种烃为有机原料,按以下路线合成M

已知:①![]() ;②
;②![]() ;
;
③![]() 。
。
请回答:
(1)化合物G的结构简式为______。
(2)下列说法不正确的是_________。
A.A→B为氧化反应
B.化合物G能与浓盐酸反应形成盐
C.化合物H与NaOH溶液反应最多消耗2molNaOH
D.局麻药M的分子式为C14H20N2O
(3)写出D+G→H的化学方程式:____________。
(4)写出满足下列条件的化合物F的所有同分异构体的结构简式________。
ⅰ.能与FeCl3溶液发生显色反应
ⅱ.能发生银镜反应
ⅲ.苯环上只有两个取代基且苯环上只有2种不同环境的氢原子
(5)该小组成员还提出另一种合成M的方案:化合物C与二乙胺[HN(CH2CH3)2]反应制取化合物X,X与G经一步反应即可制得药物M。请设计以烃A为原料制备化合物X的合成路线___________________________(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A. 混合溶液中,c(H+)=![]() mol·L-1 B. 混合溶液的pH=7
mol·L-1 B. 混合溶液的pH=7
C. a=b D. 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产硝酸钙的工业废水常含有NH4NO3,可用电解法净化。其工作原理如图所示。下列有关说法正确的是

A. a极为电源负极,b极为电源正极
B. 装置工作时电子由b极流出,经导线、电解槽流入a极
C. Ⅰ室能得到副产品浓硝酸Ⅲ室能得到副产品浓氨水
D. 阴极的电极反应式为2NO3-+12H++10e-=N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D是四种短周期元素,E是过渡元素。A,B,C同周期,C,D同主族,A的原子结构示意图为 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。试回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。试回答下列问题:
(1)写出下列元素的符号:A__________,B__________,C__________,D__________。
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是________,碱性最强的是__________。
(3)用元素符号表示D所在周期第一电离能最大的元素是________,电负性最大的元素是__________。
(4)E元素原子的核电荷数是__________,E元素在周期表的第________周期第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在________区。
(5)写出D元素原子构成单质的电子式__________,该分子中有____个σ键,____个π键。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com